
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学反应方程式正确且能设计成原电池的是_________。
A.KOH + HCl = KCl + H2O B. Cu + Fe3+ = Fe2+ + Cu2+
C.Na2O + H2O = 2NaOH D.Fe + H2SO4 = FeSO4 + H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如下图)。有关实验现象,下列说法正确的是:______。
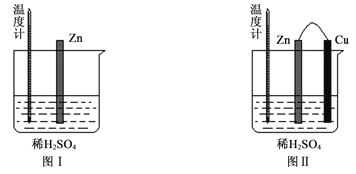
A.图I中温度计的示数高于图II的示数
B.图I和图II中温度计的示数相等,且均高于室温
C.图I和图II的气泡均产生于锌棒表面
D.图II中产生气体的速度比I慢
(3)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O
①写出放电时正极的电极反应式:___________;
②铅蓄电池放电时,负极质量将_______(填“增大”、“减小”或“不变”)。当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为_________。
【答案】D A PbO2 + 2e- + SO42-+4H+ = PbSO4 + 2H2O 增大 2mol
【解析】
(1)依据原电池反应是自发进行的氧化还原化学反应判断;
(2)依据图Ⅰ中发生的是锌的化学腐蚀,图Ⅱ形成铜-锌原电池判断;
(3)根据铅蓄电池正极发生还原反应,负极发生氧化反应判断。
(1)电池的构成原理是自发进行的氧化还原反应在理论上可以设计成原电池
A.KOH+HCl=KCl+H2O是复分解反应,不是氧化还原反应,故A错误;
B.Cu +Fe3+ =Fe2+ +Cu2+电荷不守恒,离子方程式不正确,故B错误;
C.Na2O+H2O=2NaOH是化合反应,不是氧化还原反应,故C错误;
D.Fe +H2SO4 =FeSO4+H2↑,反应是自发进行的氧化还原反应,可以设计成原电池,故D正确。
故答案为:D。
(2)图Ⅰ中发生的是锌的化学腐蚀,图Ⅱ形成铜-锌原电池
A.图Ⅰ主要将化学能转化为热能,而图Ⅱ主要将化学能转化为电能,则图I中温度计的示数高于图II的示数,故A正确;
B.由A分析可知,图I和图II中温度计的示数不相等,但均高于室温,故B错误;
C.图II铜为正极,铜的表面有气泡产生,故C错误;
D.利用原电池反应可以使金属与酸的反应速率加快,故图II中产生气体的速度比I快,故D错误。
故答案为:A。
(3)①依据放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,PbO2得电子发生还原反应,PbO2在H2SO4溶液中生成难溶于水的PbSO4,故其正极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,故答案为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O。
②依据放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,Pb失电子发生氧化反应,产生的Pb2+在H2SO4溶液中结合SO42-生成难溶于水的PbSO4,故负极质量将增大,根据总反应,转移2mol电子时,消耗2molH2SO4,所以当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为2mol,故答案为:增大,2mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,不正确的是

A. 阿克拉酮的分子式为C22H22O8
B. 分子中含有3个手性碳原子
C. 该分子一定条件下能发生取代、氧化、消去反应
D. 1 mol该物质最多可与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() 主要成分为
主要成分为![]() ,还有少量的
,还有少量的![]() ,
,![]() 等杂质
等杂质![]() 提取氧化铝作冶炼铝的原料,提取的操作过程如下:
提取氧化铝作冶炼铝的原料,提取的操作过程如下:

(1)![]() 和II步骤中分离溶液和沉淀的操作是: __________________;
和II步骤中分离溶液和沉淀的操作是: __________________;
(2)沉淀M中除含有泥沙外,一定还含有 ____________,固体N是 ____________;
(3)滤液X中,含铝元素的溶质的化学式为 ________________,它属于 _____![]() 填“酸”、“碱”或“盐”
填“酸”、“碱”或“盐”![]() 类物质;
类物质;
(4)实验室里常往![]() 溶液中加人 ________________
溶液中加人 ________________![]() 填“氨水”或“NaOH溶液”
填“氨水”或“NaOH溶液”![]() 来制取
来制取![]() ,请写出该反应的方程式 ___________________________
,请写出该反应的方程式 ___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A和2 mol B在2 L的容器中混合,并在一定条件下发生如下反应:2A(s)+B(g) ![]() 3C(g),若经2 s后测得C的浓度为0.6 mol·L-1,则
3C(g),若经2 s后测得C的浓度为0.6 mol·L-1,则
(1)用物质B表示的反应速率为_____。
(2)增加少量A,化学反应速率会____(增加、减小、不变);升高温度,化学反应速率会___(增加、减小、不变);要想减小反应速率,可以采取的措施有____(任填一项)。
(3)2s时物质B的浓度为____。
(4)对于该反应,说明反应达到化学平衡状态的有_____。
A.生成1molB,同时生成1molC B.3v(B)=v(C)
C.恒温恒容,压强不变时 D.气体的总质量不变时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数。B原子核内质子数和中子数相等。下列叙述不正确的是( )

A. C元素是非金属性最强的元素
B. A元素最高价氧化物对应的水化物具有强氧化性
C. B元素的氧化物、氢化物的水溶液都呈酸性
D. 三种元素的原子半径的大小顺序是:B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,已知:A是形成化合物种类最多的元素,它的一种同位素可用于鉴定文物年代; B2-离子与氩原子具有相同的电子层结构;C、D次外层电子都是8个,C和D的化合物CD在水溶液中能电离出的阳离子比阴离子少一个电子层;D的最高价与其负价的代数和为6。试写出:
(1)A位于元素周期表中第__周期____族,它用于鉴定文物年代的一种同位素为_____。
(2)D的气态氢化物的电子式为_____。
(3)B、C分别对应的最高价氧化物水化物之间反应的离子方程式______________。
(4)C所在族元素除______外,都叫______,试写出C与水反应的离子方程式_________;现有两种此族金属(一种在第五周期)形成的混合金属40g,当它与足量水反应时,放出标准状况下的氢气22.4L,则另一种金属是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )

A. Na+、Fe3+、K+、ClO—都可在该物质的溶液中大量共存
B. 该物质可以用于氧化还原滴定测定K2Cr2O7含量
C. 向0.1mol/L该物质的溶液中逐滴滴加0.1mol/LNaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如右图所示
D. 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42—完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式H++OH-=H2O所表示的反应可以是
A.所有酸和碱之间的中和反应B.碳酸氢钠和氢氧化钠之间的反应
C.所有可溶性酸和可溶性碱的反应D.稀硫酸与氢氧化钠的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验溴乙烷中含有溴元素存在的实验步骤、操作和顺序正确的是( )
①加入AgNO3溶液 ②加入NaOH溶液 ③加入适量HNO3④加热煮沸一段时间 ⑤冷却
A.②④⑤③①B.①②④C.②④①D.②④⑤①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com