
【题目】炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
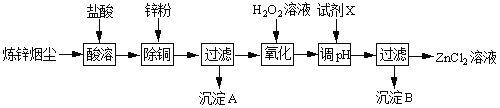
下表列出相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1.1 | 5.2 | 5.8 |
沉淀完全的pH | 3.2 | 6.4 | 8.8 |
(1)加入H2O2溶液的作用是___。
(2)流程图中,调节pH时,加入的试剂X可以是______(填序号),pH应调整到___。
A.ZnO B.NaOH C.Zn2(OH)2CO3 D.ZnSO4
【答案】使Fe2+被氧化为Fe3+ AC 3.2≤pH<5.2
【解析】
向炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)中加盐酸溶解,金属氧化物与盐酸反应形成氯化锌、氯化铜、氯化亚铁溶液,加适量锌粉置换出Cu,然后过滤,滤液中含有Fe2+和Zn2+,向滤液中加过氧化氢把溶液中的Fe2+氧化为Fe3+,再加ZnO(或Zn(OH)2等)调节pH,使Fe3+转化为Fe(OH)3沉淀,过滤除去Fe(OH)3沉淀,得到ZnCl2溶液,以此来解答。
(1)由上述分析可知,加入H2O2溶液的作用是使溶液中的Fe2+氧化为Fe3+;
(2)调节溶液的pH时,要消耗溶液中的H+,但是不能引入杂质。ZnO、Zn(OH)2、Zn2(OH)2CO3均与H+反应生成Zn2+,消耗了H+,同时不引入杂质;NaOH可以调节溶液的pH,但会引入杂质Na+;ZnSO4与H+不能反应,不能调节溶液的pH,故合理选项是AC;
调节pH时,要使溶液中的Fe3+转化为Fe(OH)3沉淀,而Zn2+仍然以离子形式存在于溶液中,不形成沉淀,由表中数据可知pH≥3.2时,Fe3+完全沉淀,而Zn2+开始沉淀的pH为5.2,所以溶液pH调节范围为:3.2≤pH<5.2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )
A.棉花和合成纤维的主要成分都是纤维素
B.蛋白质溶液中加入浓的硫酸铵溶液会发生变性
C.乙酸乙酯中混有的乙酸杂质可以用饱和碳酸钠溶液除去
D.由CH2=CH﹣COOCH3合成的聚合物为[CH2﹣CH﹣COOCH3]n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2H2(g)+02(g)=2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是

A. H1<0 B. H2为该反应的反应热
C. H3为氢气的燃烧热 D. H1=H3-H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的要紧成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如图所示。
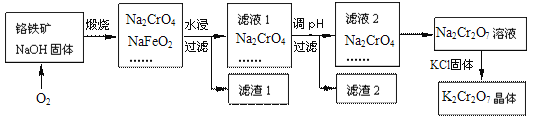
已知:①NaFeO2遇水强烈水解。
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
请回答:
(1)K2Cr2O7中Cr元素的化合价是___。
(2)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是___。
(3)滤渣1为红褐色的固体,滤渣1的成分是(填名称)____,滤液1的成分除Na2CrO4、NaOH外,还含有___(填化学式)。
(4)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是___。
(5)写出由滤液2转化为Na2Cr2O7溶液应采取的措施是___。
(6)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、____、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图中有机物的说法错误的是( )

A.该有机物的分子式为C8H9O4Br
B.1mol该有机物最多可以与3molH2反应
C.能发生酯化反应、水解反应、氧化反应
D.1mol该有机物与NaHCO3溶液反应时,最多消耗1molNaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )(已知:pH=-lgc(H+))

A.将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小
B.a、b、c三点溶液的pH:b<a<c
C.a、b、c三点CH3COOH的电离程度:c<a<b
D.a、b、c三点溶液用1 mol·L-1NaOH溶液中和,消耗NaOH溶液体积:c<a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整时发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)某温度下,向1L的密闭容器中充入0.2molCH4与0.1molCO2,发生CH4-CO2催化重整反应,10min时达到平衡,测得平衡混合物中CO(g)的体积分数为20%,则用CH4表示的反应速率为______,CO2的平衡转化率为______。
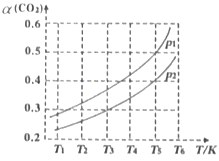
(2)若CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。由图可知:压强p1______p2(选填“>“、“<“或“=”),理由是______。
(3)在一定温度下,向固定容积为2L的密闭容器中充入0.1moCH4与0.1mo1CO2发生CH4-CO2催化重整反应,达平衡时CO2的平衡转化率为50%,则此条件下该反应的平衡常数为K=______;平衡后保持温度不变,若再充入0.15molCH4、0.15molCO2、0.1molCO、0.1molH2,则此时v正______(选填“>”、“<”或“=”)v逆。
(4)已知:C(s)+2H2(g)=CH4(g)△H1=-75 kJmol-1
C(s)+O2(g)=CO2(g)△H2=-394 kJmol-1
C(s)+![]() O2(g)=CO(g)△H3=-111 kJmol-1
O2(g)=CO(g)△H3=-111 kJmol-1
①催化重整反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的△H=______kJmol-1。
2CO(g)+2H2(g)的△H=______kJmol-1。
②反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)=C(s)+2H2(g) | 消碳反应CO2(g)+C(s)=CO(g) | ||
△H/(kJmol-1) | 75 | 172 | |
活化能/(kJmol-1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
由上表判断,催化剂X______Y(填“优于”或“劣于”),理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是

A.丙属于碱性氧化物
B.W元素在周期表中的位置是第四周期VIIIB族
C.W的原子序数是Z的两倍,金属性弱于Z
D.常温下等物质的量的甲和戊加入过量浓硝酸中,消耗的HNO3物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com