
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法不正确的是

A. 电极a和电极c都发生氧化反应
B. 电极d的电极反应式为2H++2e-=H2↑
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 装置A中每消耗64gSO2,理论上装置A和装置B中均有2moH+通过质子交换膜
【答案】C
【解析】A装置能自发的进行氧化还原反应且没有外接电源,所以是原电池,a极上二氧化硫失电子为负极,b上氧气得电子为正极,B属于电解池,与电源的正极b相连的电极c为阳极,N2O4在阳极失电子生成N2O5,d为阴极,阴极上氢离子得电子生成氢气。A.电极a为负极,电极c为阳极,负极和阳极都发生氧化反应,故A正确;B.d为阴极,阴极上氢离子得电子生成氢气,电极d的电极反应式为2H++2e-=H2↑,故B正确;C.c为阳极,N2O4发生氧化反应生成N2O5,电极上的电极反应式为N2O4-2e-+ 2HNO3 =2N2O5+2H+,故C错误;D.装置A中每消耗64g SO2,即1mol,转移电子为2mol,由电荷守恒可知,理论上装置A和装置A中均有2mol H+通过质子交换膜和隔膜,故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】我国电池的年市场消费量约为80亿只,其中70%是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体(ZnSO4·7H2O)和纯MnO2的工艺如下图所示:
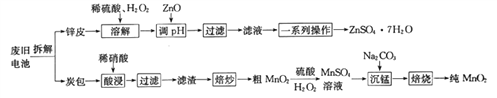
已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,还含有少量的 Cu、Ag、Fe 等。
②Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38。
(1)除去炭包中碳粉的操作为_____________。
A.酸浸 B.过滤 C.焙炒 D.焙烧
(2)粗MnO2转化为MnSO4时,主要反应的离子方程式为_____________________。
(3)焙烧时发生反应的化学方程式为_____________。
(4)制备硫酸锌晶体流程中,用ZnO调节溶液pH的目的是______________________________,若溶解时不加H2O2带来的后果是____________________。
(5)“草酸钠-高锰酸钾返滴法”可测定MnO2的纯度:取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1mol·L-1Na2C2O4溶液(足量),最后用c2mol·L-1的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为_____________。
②该样品中MnO2的质量分数为__________________(假定杂质不参与反应,列出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 只要是含碳元素的化合物一定是有机物
B. 有机物是只有在生物体内才能合成的物质
C. 冰醋酸易溶于水
D. 有机物都难溶于水,而易溶于有机溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1体积的某烃蒸气完全燃烧生成的CO2比水蒸气少1体积(同温同压下),0.1 mol该烃完全燃烧的产物被碱石灰吸收,碱石灰增重39 g,则该烃的分子式为( )
A. C6H14 B. C5H12
C. C7H16 D. C6H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. NA个H2分子占有的体积一定为22.4 L
B. 标准状况下,22 g CO2与11.2 LH2O含有相同的原子数
C. 标准状况下,16g O2与O3的混合气体中含有的原子总数为NA
D. 1 mol/L的蔗糖水溶液中含蔗糖分子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B. 图乙表示pH相同的盐酸与氢氟酸分别加水稀释PH的变化,其中曲线a对应的是氢氟酸
C. 图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D. 图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环扁桃酯是用于治疗心脑血管疾病的重要化合物。它的一种合成路线如下
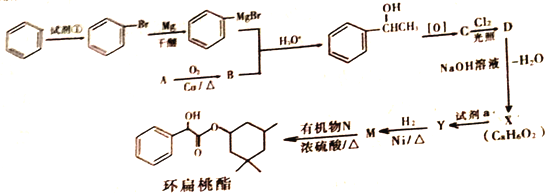
已知: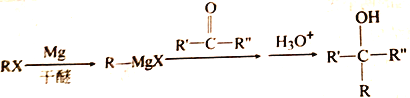 (R、R'、R〞代表烃基或氢)
(R、R'、R〞代表烃基或氢)
(1)试剂①为__________________________;
(2)写出A生成B的反应方程式______________________________;
(3)X的结构简式是______________,X→Y的反应类型是_______________________;
(4)M与N生成环扁桃酯的化学方程式是_______________________;
(5)有机物Z与Y 互为同分异构体,满足下列条件的有机物Z的结构有___________种,写出任意一种核磁共振氢谱中有4个峰,且面积之比为2 :2 :1:1的同分异构体的结构简式为_________________;
①芳香族化合物 ②能发生银镜反应,且1mol与足量的银氨溶液反应生成4molAg
(6)以CH2=CHCH3、CH3CHO为有机原料,结合题目所给信息,选用必要的无机试剂合成CH=CHCH=CHCH3,合成路线为:CH2=CHCH3![]() E
E![]() CH2=CHCH2MgBr
CH2=CHCH2MgBr![]() F
F![]() CH2=CHCH=CHCH3
CH2=CHCH=CHCH3
请依次写出反应①到④反应条件和试剂,写出E、F的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在醋酸的电离平衡中,要使平衡右移且氢离子浓度增大 ,应采取的措施是 ( )
A. 加入氢氧化钠 B. 加入盐酸 C. 向溶液中加水 D. 升高溶液温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com