
����Ŀ��﮵��ص����������Ǿ�2-��ϩ���(��дΪP2VP)��I2�ĸ��������������ڱ�Ĥ״�ĵ⻯ﮣ��õ�ط������ܷ�ӦΪ2Li+P2VP��nI2![]() P2VP��(n-1)I2+2LiI������˵����ȷ���� ( )
P2VP��(n-1)I2+2LiI������˵����ȷ���� ( )
A.�õ�طŵ�ʱ��﮵缫������ԭ��Ӧ
B.�õ�طŵ�ʱ����������������
C.P2VP��I2�ĸ������Ǿ�Ե�壬���ܵ��磬���ʱ�����Դ�ĸ�������
D.�ŵ�ʱ�����ĵ缫��ӦʽΪP2VP��nI2+2e-+2Li+=P2VP��(n-1)I2+2LiI
���𰸡�D
��������
A.�õ�طŵ�ʱ��������ӦʽΪ2Li-2e-=2Li+��﮵缫����������Ӧ��Li��������A����
B.ԭ����е�������������ɽ϶�ĸ���Li��B����
C.���������Ǿ�2-��ϩ���(��дΪP2VP)��I2�ĸ�����缫�������Ǿ�Ե�壬C����
D.﮵��ص������ĵ缫��ӦʽΪP2VPnI2+2Li++2e-=P2VP(n-1)I2+2LiI��������ӦʽΪ2Li-2e-=2Li+���ܷ�ӦΪ2Li+P2VPnI2=P2VP(n-1)I2+2LiI��D��ȷ��
�ʺ���ѡ����D��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳƷ������R�Ľṹ��ʽ����ͼ��ʾ������˵����ȷ���ǣ�������
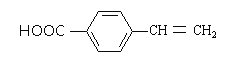
A.��CH3CH218OH����������Ӧ������H218O
B.��Na��NaOH��Na2CO3��NaHCO3��Һ����Ӧ
C.��ʹ���Ը�����ؼ���ˮ��ɫ����Ӧԭ����ͬ
D.1 mol������X�������5 mol H2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����Ũ�Ⱦ�Ϊ0.1mol��L-1��Na0H ��Һ������ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1mol��L-1��HA��Һ��BOH��Һ���ζ���������Һ��pH��μ���Һ������仯��ϵ��ͼ��ʾ������˵������ȷ����

A. HAΪ���ᣬBOHΪǿ��
B. a��ʱ����Һ������Ũ�ȴ��ڹ�ϵ��c(B+)>c(Cl-)>c(OH-)>c(BOH)
C. b��ʱ����ЭҺ��ˮ�ĵ���̶���ͬ����V=20
D. c��d������Һ��Ϻ���֮����ڹ�ϵ��c(H+)= c(OH-)+c(BOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��в�ҩ�Ļ�ԴԶ������ͨ���ٴ����飬��ij�в�ҩ����ȡ���л�����нϺõ����ư�֢�����ã����л���Ľṹ��ͼ��ʾ������˵���д�����ǣ� ��

A.����ʽΪC13H12O6
B.���л����ܷ���ȡ����Ӧ���ӳɷ�Ӧ��������Ӧ
C.1mol���л�����NaOH��Ӧ�������2molNaOH
D.1mol���л�������ˮ��Ӧ�������3molBr2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ���ں���Pb2����Sn2����ij��Һ�У����������������Sn����������Ӧ��Sn��s����Pb2����aq��![]() Sn2����aq����Pb��s������ϵ��c��Pb2������c��Sn2�����仯��ϵ��ͼ22��ʾ�������ж���ȷ���ǣ� ��
Sn2����aq����Pb��s������ϵ��c��Pb2������c��Sn2�����仯��ϵ��ͼ22��ʾ�������ж���ȷ���ǣ� ��

A. ��ƽ����ϵ�м������Ǧ��c��Pb2��������
B. ��ƽ����ϵ�м�������Sn��NO3��2�����c��Pb2������С
C. �����¶ȣ�ƽ����ϵ��c��Pb2��������˵���÷�Ӧ��H��0
D. 25 ��ʱ���÷�Ӧ��ƽ�ⳣ��K��2.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����20.00mL0.10mol��L-1��һԪ��HR��Һ�е���0.10mol��L-1NaOH��Һ����ҺpH��NaOH��Һ����Ĺ�ϵ��ͼ��ʾ��

����˵������ȷ���ǣ� ��
A..T��ʱ��HR���볣��Ka��1.0��10-5
B.M���Ӧ��NaOH��Һ���Ϊ20.00mL
C.N����Q����ʾ��Һ��ˮ�ĵ���̶ȣ�N>Q
D.M����ʾ��Һ��c(Na+)=c(R-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��״���£�CO��һ����ɫ����ζ���ж������壬������ˮ�����ᡢ�����Һ������Ӧ���ƾ���ƿ�����������Դ����ȷ������ͼ��ʾ��װ�ý���ʵ�飬������֤ij�������ijɷ���CO2��CO��ÿ��װ������һ��������ش��������⣺

��1������װ�õ��ܿڵ�˳���������__________________��β����������ܽӿڴ�������
��2��֤��ԭ���������CO2���ڵ�ʵ��������__________________________________��
֤��CO���ڵ��йط�Ӧ�Ļ�ѧ����ʽ��__________________________________________��
��3����ͬѧ�������BӦ��ʹ��һ�Σ�����Ϊ�е�����________��������������û�����������������ɣ�
_________________________________________________________________��
��4����ʵ��β�������ķ�����________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�������ʵ����仯ͼ����������20mL0.2mol/LH2A��Һ�еμ�0.2mol/LNaOH��Һ������˵����ȷ����
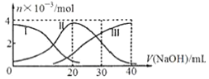
A.H2A��ˮ�еĵ��뷽��ʽ�ǣ�H2A��2H++A2-
B.��V(NaOH)=20mLʱ�����У�c(Na+)��c(HA-)��c(H+)��c(A2-)��c(OH-)
C.��V(NaOH)=30mLʱ�����У�2c(H+)+c(HA-)+2c(H2A)= c(A2-)+2c(OH-)
D.��V(NaOH)=40mLʱ������Һ��ˮ�ĵ����ܵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����8.8g FeS��������200mL 2.0molL��1�������У����Ʊ�H2S���壮��Ӧ��ȫ������Һ��H2S��Ũ��Ϊ0.10molL��1���ٶ���Һ������䣬�Լ��㣺
��1���ռ�����H2S������������״������__________
��2����Һ��Fe2+��H+�����ʵ���Ũ�ȣ�Ħ��Ũ�ȣ���___________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com