
【题目】肼(N2H4)和亚硝酸钠在化工生产及航天工业中具有十分广泛的应用,下图是以液氨为原料生产肼和亚硝酸钠的工艺流程(肼能与水混溶,形成稳定的N2H4H2O):
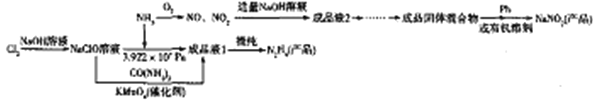
回答下列问题:
(1)NaNO2中N的化合价为_______。
(2)写出在NaClO溶液中通入NH3得到成品液1的化学反应方程式:______________。
(3)由成品液2得到成品固体混合物需经过的操作步骤为________________。
(4)亚硝酸钠在一定条件下能与无水肼反应生成一种钠氮化合物和水,生成的钠氮化合物中钠的质量分数为35.38%。则反应中氧化剂与还原剂的物质的量之比为_____;该反应中的氧化产物是___________________。
(5)已知所得成品固体混合物中含有2种钠盐,若要获得NaNO2产品,则需要除去的物质为_______(填化学式);使用Pb进行处理时,杂质能转变为NaNO2,而Pb转化成PbO,则这一处理过程发生反应的化学方程式为___________;已知,NaNO2在邻苯二甲酸二丁酯中溶解度远大于在水中的溶解度,而另一钠盐则不具有该性质,若用有机溶剂邻苯二甲酸二丁酯处理成品固体混合物水溶液时,NaNO2 与另一钠盐通过_____(填操作名称)被分离。
【答案】 +3 2NH3+NaClO![]() N2H4·H2O+NaCl 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 1:1 NaN3 NaNO3 NaNO3+Pb==NaNO2+PbO 分液
N2H4·H2O+NaCl 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 1:1 NaN3 NaNO3 NaNO3+Pb==NaNO2+PbO 分液
【解析】(1)根据化学式中正负化合价代数和为0,可得N化合价为+3价。
(2)由已知,肼能与水混溶形成稳定的N2H4H2O ,N为2价,所以![]() 与
与 ![]() 发生氧化还原反应生成N2H4H2O和NaCl,故化学方程式为2NH3+NaClO
发生氧化还原反应生成N2H4H2O和NaCl,故化学方程式为2NH3+NaClO![]() N2H4H2O+NaCl。
N2H4H2O+NaCl。
(3)从溶液中得到固体溶质的一般方法步骤为:蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
(4)钠氮化合物中钠的质量分数为35.38%,氮的质量分数为64.62%,设钠氮化合物化学式为NaxNy,则![]() =
=![]() ,解得
,解得![]() ≈
≈![]() ,故钠氮化合物化学式为NaN3,所以亚硝酸钠与无水肼反应的化学方程式为:
,故钠氮化合物化学式为NaN3,所以亚硝酸钠与无水肼反应的化学方程式为:![]() +
+![]() =
=![]() +
+ ![]() ,所以
,所以![]() 是氧化剂,
是氧化剂,![]() 是还原剂,
是还原剂,![]() 既是氧化产物又是还原产物。
既是氧化产物又是还原产物。
(5)NO、NO2与NaOH溶液反应为:NO+NO2+2NaOH=2NaNO2+H2O、3NO2+2NaOH= 2NaNO3+H2O+NO,若所得成品固体混合物中含有2种钠盐,要获得NaNO2产品,则需要除去的物质为NaNO3;若使用Pb进行处理时,杂质能转变为NaNO2,而Pb转化成PbO,则化学方程式为:NaNO3+Pb=NaNO2+PbO;对于在同一溶剂中溶解度差别很大的物质可以用萃取分液的方法进行分离,由已知NaNO2在邻苯二甲酸二丁酯中溶解度远大于在水中的溶解度,而另一钠盐则不具有该性质,所以可用有机溶剂邻苯二甲酸二丁酯处理成品固体混合物水溶液,然后进行分液操作。


科目:高中化学 来源: 题型:
【题目】对滴有酚酞试剂的下列溶液,操作后颜色变深的是
A.明矾溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知拆开或形成1 mol化学键所吸收或放出的能量叫做该化学键的键能,单位kJ·mol-1。白磷在氧气中燃烧的化学方程式可用结构式表示为如图所示:
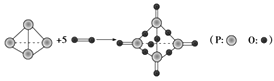
试根据下表中的化学键键能计算0.1molP4(白磷)在氧气中充分燃烧放出能量_____kJ。
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | 198 | 360 | 498 | 585 |
Ⅱ.化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是_________(填序号)。
A. 2FeBr2 + 3Cl2 = 2FeCl3+2Br2
B. Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
C. 2H2O = 2H2↑+O2↑
D. Cu+2AgNO3 = 2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。
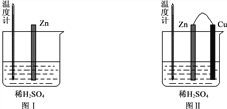
有关实验现象,下列说法正确的是:_____________(填序号)。
图Ⅰ中气泡产生在锌棒表面,Ⅱ中产生在铜棒表面
图Ⅰ和图Ⅱ的气泡均产生在锌棒表面
两图中生成气体的速率几乎一样快
图Ⅱ中产生气体的速度比Ⅰ快
温度计显示的均为室温
图Ⅱ中温度计的示数高于图Ⅰ的示数
图Ⅰ中温度计的示数高于图Ⅱ的示数
图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
(3)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为____________________,一段时间后,负极增重48克,转移电子_______mol。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
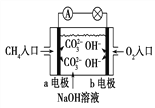
①电池的负极反应式为: ____________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系如图,则下列说法正确的是( )

A . Z、N两种元素形成的化合物熔融状态下可以导电
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由X与M两种元素组成的化合物能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品及工业原料。
某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式________________________
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是____________(填字母代号)。
A.10mol N2、30mol H2和20mol NH3
B.10mol N2和30mol H2
C.20mol N2和60mol H2
D.10mol N2和28mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要的化工原料
(1)已知: N2(g)+O2(g)= 2NO(g) △H = +180.5kJ·mol-1
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H = -905kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:
;如果在1L密闭容器中,3mol NH3 在等温条件下充分反应,2min后达到平衡,平衡时的反应热为92.4kJ ,则在这段时间内v(H2)= ;保持温度不变,将起始NH3的物质的量调整为8mol,平衡时NH3的转化率为 。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
A.增大压强 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2===Fe+2Li2S。下列说法不正确的是( )
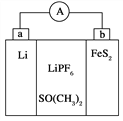
A. 可以用水代替SO(CH3)2做溶剂
B. 电子移动方向是由a极流向b极
C. 该装置将化学能转化为电能
D. b极反应式为FeS2+4Li++4e-===Fe+2Li2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com