
食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,可降低温度,延长食品保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e-=Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:单选题
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是( )
| A.锂电极作电池负极,放电过程中发生还原反应 |
| B.1 mol SOCl2发生电极反应转移的电子数为4 mol |
| C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2 |
| D.组装该电池必须在无水、无氧的条件下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于原电池的叙述中错误的是
| A.构成原电池的正极和负极必须是两种不同的金属 |
| B.原电池是将化学能转变为电能的装置 |
| C.在原电池中,电子流出的一极是负极,发生氧化反应 |
| D.原电池放电时,电流的方向是从正极经导线到负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关下列装置的叙述不正确的是

| A.图①铝片发生的电极反应式是:Al+4OH--3e-===AlO2-+2H2O |
| B.图②发生析氢腐蚀,离子反应方程式为:Fe+2H+===Fe2++H2↑ |
| C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O===4Fe(OH)3 |
| D.图④充电时,阳极反应是:PbSO4+2H2O-2e-===PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
按下图的装置进行试验,若图中X轴表示阴极的电子的量,则Y轴可能表示为( )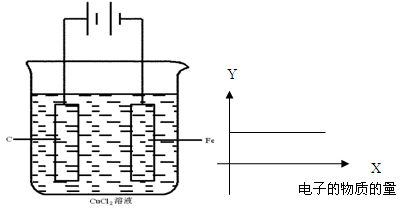
| A.Cu2+物质的量浓度 | B.C棒的质量 |
| C.Fe棒的质量 | D.Cl-物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①在标准状况下,每消耗5.6L CH4可以向外电路提供2mole-
②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
③通过甲烷的电极为电池的正极,通过氧气的电极为负极
④电池放电后,溶液碱性增强
| A.①② | B.①③ | C.①④ | D.③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2→ 4B2O3 + 2V2O5 。下列说法正确的是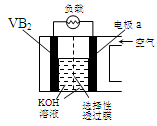
| A.电极a为电池负极 |
| B.图中选择性透过膜只能让阳离子选择性透过 |
| C.电子由VB2极经KOH溶液流向a电极 |
| D.VB2极发生的电极反应为: |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是 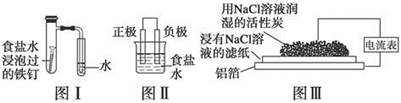
| A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管 |
| B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁 |
| C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-===Cl2↑ |
| D.图Ⅲ装置的总反应为4Al+3O2+6H2O===4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述错误的是
| A.生铁中含有碳,抗腐蚀能力比纯铁弱 |
| B.用锡焊接的铁质器件,焊接处易生锈 |
| C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| D.铁管上镶嵌锌块,铁管不易被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com