
【题目】下列离子方程式正确的是
A.Al(OH)3溶于足量的NaOH溶液:Al(OH)3+OH-=AlO2-+2H2O
B.Na2O2与H2O反应:Na2O2+H2O=2Na++2OH-+O2↑
C.氯气与水的反应:Cl2+H2O=2H++Cl-+ClO-
D.盐酸中滴加氨水:H++OH-=H2O
科目:高中化学 来源: 题型:
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
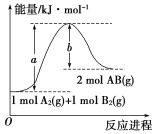
(1)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示请写出该反应的热化学方程式____。
(2)实验测得,1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,试写出乙醇燃烧的热化学方程式:_______。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为_________。
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是
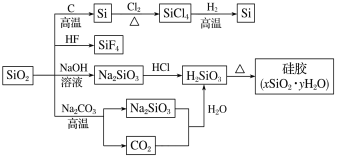
A.SiO2属于两性氧化物B.酸性:H2SiO3>H2CO3
C.硅胶吸水后可重复再生D.图中所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,反应2NO+O2![]() 2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()

A.a点B.b点C.c点D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)为了防止FeSO4溶液变质,应在溶液中加入少量的_________(元素符号表示)。
(2)人体血液中的下列物质不属于电解质的是_________(填序号,下同)。
a.H2CO3 b.葡萄糖(C6H12O6)
c.NaHCO3 d.NaCl
(3)区分Na2CO3和NaHCO3溶液可选用的方法或试剂是_________。
a.CaCl2溶液 b.焰色试验
c.Ca(OH)2溶液 d.NaOH溶液
(4)下列变化中,不涉及氧化还原反应的是_________。
a.金属的冶炼 b.钢铁的锈蚀
c.钟乳石的形成 d.食物的变质
(5)下列过程必须加入氧化剂才能实现的是_________。
a.Cl2→ClO- b.NH3→NH4+
c.KMnO4→MnO2 d.Fe2+→Fe3+
(6)质量相同的两份铝粉,分别放入足量的盐酸和NaOH溶液,放出的H2在同温同压下体积之比为__________________。
(7)明矾〔硫酸铝钾的结晶水合物:KAl(SO4)2·12H2O〕是一种常用添加剂,明矾在水中能电离出两种金属离子和酸根离子。写出硫酸铝钾电离方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 ③实验室常用排饱和食盐水的方法收集氯气 ④棕红色NO2加压后颜色先变深后变浅 ⑤加入催化剂有利于合成氨的反应 ⑥由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深 ⑦500℃时比室温更有利于合成氨的反应 ⑧将混合气体中的氨液化有利于合成氨反应
A. ①②⑥⑧B. ①③⑤⑦C. ②⑤⑥⑦D. ②③⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁是橡胶制品的优良填充剂及补强剂,补强效果优于碳酸钙及陶土,其折射率与天然橡胶相近,适于制造透明或半透明制品。碱式碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
回答下列问题:
(1)碱式碳酸镁中各元素的第一电离能由大到小的顺序为 _______________,写出一种与CO32-互为等电子体的常见微粒_______________,原子序数与CO32-的价电子数之和相等的基态原子的价电子排布式为________。
(2)碱式碳酸镁晶体生长液中生长的3种生长基元的结构如图所示:
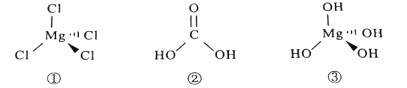
①(MgCl4)2-;②H2CO3;③[Mg(OH)4]2-
①和③中Mg原子的杂化方式为_______________,②中C原子的价电子对的几何分布形式为_______________。(MgCl4)2-中镁氯原子之间的距离R=0.25nm,则氯氯原子之间的距离为_______________(保留两位小数,已知![]() =2.45,cosl09°28'=
=2.45,cosl09°28'=![]() )。
)。
(3)碱式碳酸镁加热可分解生成MgO。已知MgO的晶体结构属于NaCl型,某同学画出的MgO晶胞结构如图所示:

①请改正图中错误_______________(用文字表述)。
②在MgO晶体中,Mg2+的配位数为_______________,每个晶胞中所包含的Mg2+数目为_______________,每个Mg2+距离最近的且等距离的Mg2+数目为_______________。
③和某些离子化合物相比,MgO是一种优良的耐高温材料的内在原因为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中![]() 的的含量及有效地开发利用
的的含量及有效地开发利用![]() ,也正成为科学家研究的主要课题。利用
,也正成为科学家研究的主要课题。利用![]() 直接加氢合成二甲醚包括以下三个相互联系的反应。
直接加氢合成二甲醚包括以下三个相互联系的反应。
I甲醇的合成![]()
II甲醇脱水![]()
Ⅲ逆水汽变换![]()
已知:相关物质变化的焓变示意图如下:
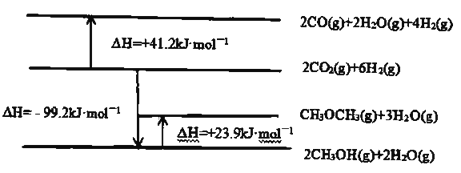
(1)请写出![]() 直接加氢合成二甲醚的热化学方程式:________________。
直接加氢合成二甲醚的热化学方程式:________________。
(2)保持恒温恒容的条件,当a充入![]() 、b充入
、b充入![]() ,在其他条件不变时,请在下图中分别画出平衡时
,在其他条件不变时,请在下图中分别画出平衡时![]() 的体积分数随投料比
的体积分数随投料比![]() 变化的曲线图,请用a、b标注曲线图。_________
变化的曲线图,请用a、b标注曲线图。_________
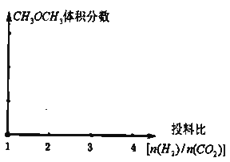
(3)在恒容密闭容器里按体积比为![]() 充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是________________。
充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是________________。
A.正反应速率先增大后减小
B.逆反应速率先增大后减小
C.化学平衡常数K值增大
D.反应物的体积分数增大
(4)温度、压强对反应中![]() 平衡转化率和二甲醚的选择性的影响如下图1,图2:
平衡转化率和二甲醚的选择性的影响如下图1,图2:
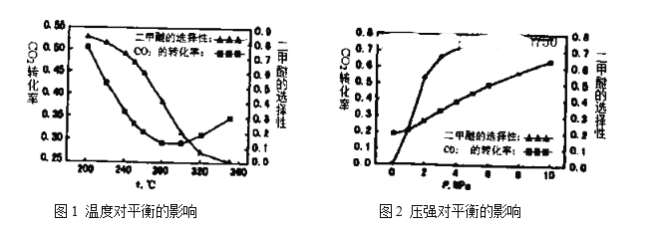
①根据图1,下列说法正确的是________。
A.温度较高时,反应以逆水汽变换反应为主,温度升高,反应速率加快,所以![]() 转化率增大
转化率增大
B.温度较低时,反应以合成二甲醚为主,正反应放热,升高温度,![]() 平衡转化率降低
平衡转化率降低
C.由图像可知,![]() 加氢合成二甲醚应该选择具有良好的低温活性的催化剂
加氢合成二甲醚应该选择具有良好的低温活性的催化剂
D.由图像可知,高温有利于逆水汽变换反应,而不利于二甲醚的生成
②根据图2可知:随着压强升高,![]() 平衡转化率和二甲醚的选择性都增大,分析原因:__________。
平衡转化率和二甲醚的选择性都增大,分析原因:__________。
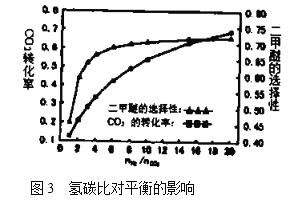
(5)在![]() ,压强为3.0MPa的反应条件下,氢碳比
,压强为3.0MPa的反应条件下,氢碳比![]() 对
对![]() 转化率和二甲醚选择性的影响见图3.分析实际工业生产中制备二甲醚选择氢碳比在3~6之间的原因:________________。
转化率和二甲醚选择性的影响见图3.分析实际工业生产中制备二甲醚选择氢碳比在3~6之间的原因:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com