
【题目】如图曲线表示其他条件一定时,反应2NO+O2![]() 2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()

A.a点B.b点C.c点D.d点
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】含氯消毒剂有多种,二氧化氯可用于自来水消毒,84消毒液用于家庭、宾馆的消毒。
I.实验室可用亚氯酸钠固体与应制备ClO2:2NaClO2+Cl2=2ClO2+2NaCl,装置如图所示:
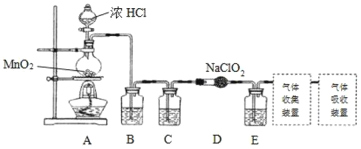
(1)装置A中,盛装浓盐酸的仪器名称为___,开始反应后,圆底烧瓶内发生的反应的离子反应方程式为:__。
(2)已知常温常压下,ClO2和Cl2是气体,在不同溶剂中溶解性如表所示:B、C、E装置中的试剂依次是___(填编号)
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 易溶 |
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.CCl4
(3)使用ClO2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。Fe2+消除ClO2-的离子方程式为__。
II.某同学在家中自制出与“84消毒液”成分(NaClO和水)相同的消毒液。主要器材有6V变压器、两支木杆铅笔、废纯净水瓶、食盐、卫生纸、绝缘胶布、小刀等。
(4)实验过程:向一个废弃的纯净水瓶中灌入大半瓶自来水,并加入3调味匙食盐,用卫生纸将用铅笔做成的电极包好,并插入纯净水瓶中,使电极恰好卡在瓶口,装置如图,接通电源后,可以看到一侧电极无明显现象,另一侧电极有细小的气泡产生,请写出该电极反应式为:___;持续通电约3小时后,发现原先无明显现象的电极附近也开始产生一定量的细小气泡,此电极此时的电极反应式___。看到该现象后停止通电。

(5)用该方法制备消毒液的总化学方程式是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(57.3)kJ/mol
B.CO(g)的燃烧热是ΔH=283.0kJ/mol,则2CO(g)+O2(g)=2CO2(g)反应的ΔH=(2×283.0)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置(部分夹持装置已略去)可以达到对应实验目的的是
A.制备氢氧化铁胶体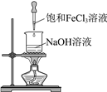 B.分离乙酸乙酯和饱和Na2CO3溶液
B.分离乙酸乙酯和饱和Na2CO3溶液
C.除去CO2中的少量HCl  D.收集NO2
D.收集NO2 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是____________________________;
(3)实验室中现有![]() 、
、![]() 、
、![]() 、
、![]() 等4中溶液,可与实验中
等4中溶液,可与实验中![]() 溶液起相似作用的是______________________________________;
溶液起相似作用的是______________________________________;
(4)要加快上述实验中气体产生的速率,还可采取的措旌有________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
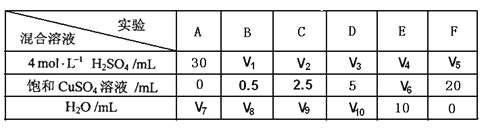
①请完成此实验设计,其中:V1=______,V6=______,V9=______;
②该同学最后得出的结论为:当加入少量![]() 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的![]() 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.Al(OH)3溶于足量的NaOH溶液:Al(OH)3+OH-=AlO2-+2H2O
B.Na2O2与H2O反应:Na2O2+H2O=2Na++2OH-+O2↑
C.氯气与水的反应:Cl2+H2O=2H++Cl-+ClO-
D.盐酸中滴加氨水:H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用如图装置制取一定量的饱和氯水,并进行氯水的性质实验。
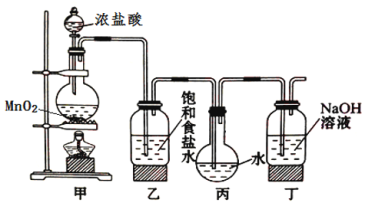
(1)在装入药品前应进行的操作____________________________________________。
(2)写出丁装置中发生反应的离子方程式:_______________________。
(3)用制得的饱和氯水分别进行下列实验:
①滴入碳酸钠溶液中,有气体生成,说明氯水中发生反应的粒子是___________;
②滴到蓝色石蕊试纸上的现象:_________________________________________。
(4)久置的氯水漂白效果明显不足或消失,用化学方程式表示:_________________。
(5)将制得的饱和氯水慢慢滴入含有酚酞的NaOH稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种(简要文字说明):
①__________________________________________________________________;
②__________________________________________________________________。
用实验证明红色褪去的原因是①或者②的实验方法是:___________。
(6)科学家提出,使用氯气对自来水消毒时,氯气会与水里的有机物反应,生成的有机氯化物可能对人体有害,现已开始使用新的自来水消毒剂,如_________________(举两例,写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)===PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是“铁链状”图案,图中相连的两物质可归属于同一类别,相交部分A、B、C、D为其相应的分类依据代号。
![]()
(1)①写出相邻两种物质之间能发生反应的化学方程式______________________________
②写出除去NaCl溶液中杂质FeCl3的化学方程式__________________________。
(2)请简述选用图中物质制备Fe(OH)3胶体的实验操作_________________________。
(3)以下框图中化合物A是上述链状图中的一种物质,是生活中常见的一种调味品,如下图是该物质在化工生产中的一系列反应;其中化合物F俗称烧碱,单质C也是上述链状图中的一种物质。
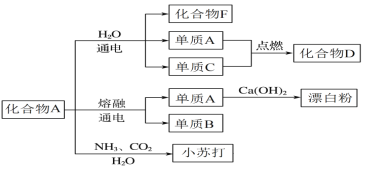
①写出单质B与H2O反应的离子方程式______________________________。
②单质A与Ca(OH)2反应制取漂白粉的化学方程式为 ________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com