
【题目】含氯消毒剂有多种,二氧化氯可用于自来水消毒,84消毒液用于家庭、宾馆的消毒。
I.实验室可用亚氯酸钠固体与应制备ClO2:2NaClO2+Cl2=2ClO2+2NaCl,装置如图所示:
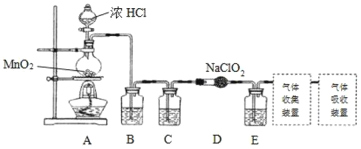
(1)装置A中,盛装浓盐酸的仪器名称为___,开始反应后,圆底烧瓶内发生的反应的离子反应方程式为:__。
(2)已知常温常压下,ClO2和Cl2是气体,在不同溶剂中溶解性如表所示:B、C、E装置中的试剂依次是___(填编号)
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 易溶 |
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.CCl4
(3)使用ClO2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。Fe2+消除ClO2-的离子方程式为__。
II.某同学在家中自制出与“84消毒液”成分(NaClO和水)相同的消毒液。主要器材有6V变压器、两支木杆铅笔、废纯净水瓶、食盐、卫生纸、绝缘胶布、小刀等。
(4)实验过程:向一个废弃的纯净水瓶中灌入大半瓶自来水,并加入3调味匙食盐,用卫生纸将用铅笔做成的电极包好,并插入纯净水瓶中,使电极恰好卡在瓶口,装置如图,接通电源后,可以看到一侧电极无明显现象,另一侧电极有细小的气泡产生,请写出该电极反应式为:___;持续通电约3小时后,发现原先无明显现象的电极附近也开始产生一定量的细小气泡,此电极此时的电极反应式___。看到该现象后停止通电。

(5)用该方法制备消毒液的总化学方程式是:___。
【答案】分液漏斗 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O b、a、d ClO2-+4Fe2++10H2O=4Fe(OH)3+Cl-+8H+ 2H++2e-=H2↑ 2Cl--2e-=Cl2↑ Cl2+2NaOH=NaClO+NaCl+H2O
Mn2++Cl2↑+2H2O b、a、d ClO2-+4Fe2++10H2O=4Fe(OH)3+Cl-+8H+ 2H++2e-=H2↑ 2Cl--2e-=Cl2↑ Cl2+2NaOH=NaClO+NaCl+H2O
【解析】
I.由题给信息和实验装置图可知:实验首先用浓盐酸和MnO2在加热条件下反应制备Cl2,经除杂、干燥后在D中与亚氯酸钠固体反应生成ClO2,B装置除去氯气中的氯化氢,C装置用浓硫酸进行干燥,因为Cl2易溶于CCl4,E用于除去ClO2中未反应的Cl2,最后收集,并处理尾气。据此进行分析。
II.该实验过程为电解食盐水的反应过程,发生反应:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,根据电解原理,可知刚开始主要产生了氢气,持续通电,另一电极生成了Cl2。Cl2与电解生成的NaOH反应生成NaClO、NaCl和水,据此分析。
2NaOH+Cl2↑+H2↑,根据电解原理,可知刚开始主要产生了氢气,持续通电,另一电极生成了Cl2。Cl2与电解生成的NaOH反应生成NaClO、NaCl和水,据此分析。
(1)根据分析,装置A为浓盐酸和MnO2在加热条件下反应制备Cl2的过程,装置A中,盛装浓盐酸的仪器为分液漏斗,开始反应后发生的离子反应方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。答案为:分液漏斗;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O。答案为:分液漏斗;MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)由分析可知,B装置用于除去混在Cl2中的HCl,B装置中的试剂应为饱和食盐水;C装置为干燥装置,试剂为浓硫酸;E装置是用于除去未反应的Cl2,结合题给ClO2和Cl2的性质表格,可知E装置中的试剂应为CCl4。答案为:b、a、d;
(3)根据题给信息,可知Fe2+和ClO2-反应生成了Fe(OH)3和Cl-,其中铁元素的化合价升高,氯元素的化合价降低,根据氧化还原反应中化合价升降总数相等以及原子守恒、电荷守恒等规律,可知该离子方程式为:ClO2-+4Fe2++10H2O=4Fe(OH)3+Cl-+8H+;答案为:ClO2-+4Fe2++10H2O=4Fe(OH)3+Cl-+8H+;
II.(4)由分析可知,首先在阴极上发生还原反应生成了H2,电极反应方程式为:2H++2e-=H2↑。继续通电,阳极发生氧化反应,生成了Cl2,电极反应方程式为:2Cl--2e-=Cl2↑。答案为:2H++2e-=H2↑;2Cl--2e-=Cl2↑;
(5)生成的Cl2与NaOH发生反应:Cl2+2NaOH=NaClO+NaCl+H2O,答案为:Cl2+2NaOH=NaClO+NaCl+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25℃先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.lmol/L的KOH溶液以测定氯水的浓度。此过程中溶液pH变化的曲线如图所示。
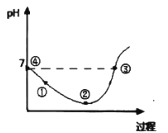
下列叙述中正确的是( )
A.滴定过程中,当水电离的c(H+)=10-7mol/L时,溶液显中性
B.滴定过程中宜选用酚酞为指示剂,不宜选用甲基橙为指示剂
C.②点的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-)
D.③点溶液中c(K+)+c(H+)=c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法不正确的是

A.反应过程①的热化学方程式为A2(g)+B2(g)=C(g) ΔH1=-Q kJ/mol
B.反应过程②的热化学方程式为C(g)=A2(g)+B2(g) ΔH2=+Q1 kJ/mol
C.Q与Q1的关系:Q>Q1
D.ΔH2>ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态肼(N2H4)燃料电池被广泛应用于发射通讯卫星、战略导弹等运载火箭中。以固体氧化物为电解质,生成物为无毒无害的物质。下列有关该电池的说法不正确的是( )

A.a电极上的电极反应式为N2H4+2O2--4e-=N2↑+2H2O
B.电子流动方向:电极a→电极b
C.b极附近的pH值变大
D.当电极a上消耗1molN2H4时,电极b上被还原的O2在标准状况下体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
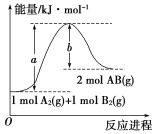
(1)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示请写出该反应的热化学方程式____。
(2)实验测得,1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,试写出乙醇燃烧的热化学方程式:_______。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变为_________。
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列研究目的和示意图相符的是( )
① | ② | ③ | ④ | |
研 | 固定容积的密闭容器中,压强对反应: | 固定容积的密闭容器中,温度对反应: | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应: | 等质量Na、K 分别与足量水反应 |
示 |
|
|
|
|
A. ①B. ②C. ③D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,反应2NO+O2![]() 2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()

A.a点B.b点C.c点D.d点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com