
【题目】相同条件下,下列装置中指定电极的电极反应式相同的是( )
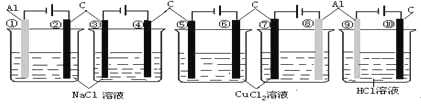
A. ②④⑥⑦⑩B. ①③⑤⑧⑨C. ②③④⑤⑥⑦⑩D. ①③⑤⑦⑨
【答案】A
【解析】
图中装置均是电解池,
①为阴极,溶液中氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑;
②为阳极,溶液中氯离子失电子生成氯气,电极反应式为2Cl--2e-=Cl2↑;
③为阴极,溶液中氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑;
④为阳极,溶液中氯离子失电子生成氯气,电极反应式为2Cl--2e-=Cl2↑;
⑤为阴极,溶液中铜离子得电子生成铜,电极反应式为Cu2++2e-=Cu;
⑥为阳极,溶液中氯离子失电子生成氯气,电极反应式为2Cl--2e-=Cl2↑;
⑦为阳极,溶液中氯离子失电子生成氯气,电极反应式为2Cl--2e-=Cl2↑;
⑧为阴极,溶液中铜离子得电子生成铜,电极反应式为Cu2++2e-=Cu;
⑨为阴极,溶液中氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑;
⑩为阳极,溶液中氯离子失电子生成氯气,电极反应式为2Cl--2e-=Cl2↑;
所以电极反应式相同的为②④⑥⑦⑩;
故选A。


科目:高中化学 来源: 题型:
【题目】关于化学反应,下列叙述中不正确的是 ( )
①放热的反应发生时不必加热 ②化学反应一定有能量变化 ③吸热反应需要加热后才能发生 ④化学反应热效应数值与参加反应的物质的量多少有关。
A. ②④B. ②③C. ①③D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题:
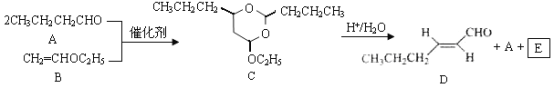
已知: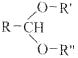
![]() RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。
(2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式:__________。
(3)E为有机物,能发生的反应有__________。
a.聚合反应b.加成反应c.消去反应d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:________。
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。
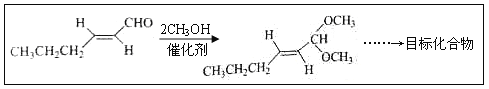
(6)问题(5)的合成路线中第一步反应的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小王要制备纯净的二氧化碳气体,可供选用的仪器如图所示。可供选用的药品如下:①石灰石②澄清石灰水③稀硫酸④浓硫酸⑤盐酸溶液⑥烧碱溶液⑦蒸馏水。下列装置连接顺序及组合最恰当的是( )

A. A(①⑤)、B(④)、C(⑦)、DB. A(①③)、B(④)、C(⑦)、D
C. A(①⑤)、B(⑦)、C(④)、DD. A(①⑤)、B(⑥)、C(④)、D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为100mL、浓度均为的两种一元碱MOH和ROH的溶液中,分别通入HCl气体,![]() 随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )
随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)( )
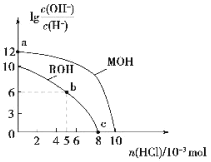
A.MOH是强碱,ROH是弱碱
B.a点由水电离产生的c(H+)和c(OH-)的乘积为1×10-26
C.b点溶液中:c(Cl-)>c(R+)>c(H+)>c(OH-)
D.c点溶液的pH=7,且所含溶质为ROH和RCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯消毒剂有多种,二氧化氯可用于自来水消毒,84消毒液用于家庭、宾馆的消毒。
I.实验室可用亚氯酸钠固体与应制备ClO2:2NaClO2+Cl2=2ClO2+2NaCl,装置如图所示:
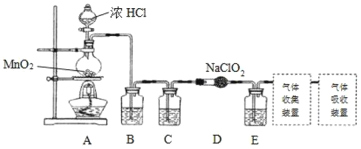
(1)装置A中,盛装浓盐酸的仪器名称为___,开始反应后,圆底烧瓶内发生的反应的离子反应方程式为:__。
(2)已知常温常压下,ClO2和Cl2是气体,在不同溶剂中溶解性如表所示:B、C、E装置中的试剂依次是___(填编号)
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 易溶 |
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.CCl4
(3)使用ClO2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。Fe2+消除ClO2-的离子方程式为__。
II.某同学在家中自制出与“84消毒液”成分(NaClO和水)相同的消毒液。主要器材有6V变压器、两支木杆铅笔、废纯净水瓶、食盐、卫生纸、绝缘胶布、小刀等。
(4)实验过程:向一个废弃的纯净水瓶中灌入大半瓶自来水,并加入3调味匙食盐,用卫生纸将用铅笔做成的电极包好,并插入纯净水瓶中,使电极恰好卡在瓶口,装置如图,接通电源后,可以看到一侧电极无明显现象,另一侧电极有细小的气泡产生,请写出该电极反应式为:___;持续通电约3小时后,发现原先无明显现象的电极附近也开始产生一定量的细小气泡,此电极此时的电极反应式___。看到该现象后停止通电。

(5)用该方法制备消毒液的总化学方程式是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乙醇燃烧是生成物总能量高于反应物总能量的反应
B. 稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3 kJ/mol可表示稀硫酸与稀Ba(OH)2溶液反应的中和热为△H=﹣57.3 kJ/mol
C. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣QkJ/mol可以表示H2S的燃烧热
D. 高温下,某反应达到平衡,平衡常数为K=![]() ,恒容时,温度升高,H2浓度减小,故该反应的焓变为正值
,恒容时,温度升高,H2浓度减小,故该反应的焓变为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____________,△H____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6s时c(A)=_____mol·L-1, C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为_____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_________;
(3)判断该反应是否达到平衡的依据为______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为_____________。
A(g)+B(g)的平衡常数的值为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是____________________________;
(3)实验室中现有![]() 、
、![]() 、
、![]() 、
、![]() 等4中溶液,可与实验中
等4中溶液,可与实验中![]() 溶液起相似作用的是______________________________________;
溶液起相似作用的是______________________________________;
(4)要加快上述实验中气体产生的速率,还可采取的措旌有________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
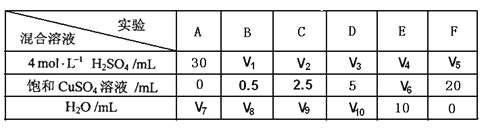
①请完成此实验设计,其中:V1=______,V6=______,V9=______;
②该同学最后得出的结论为:当加入少量![]() 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的![]() 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com