
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是____________________________;
(3)实验室中现有![]() 、
、![]() 、
、![]() 、
、![]() 等4中溶液,可与实验中
等4中溶液,可与实验中![]() 溶液起相似作用的是______________________________________;
溶液起相似作用的是______________________________________;
(4)要加快上述实验中气体产生的速率,还可采取的措旌有________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
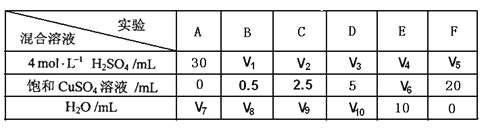
①请完成此实验设计,其中:V1=______,V6=______,V9=______;
②该同学最后得出的结论为:当加入少量![]() 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的![]() 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________
【答案】Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4=ZnSO4+H2↑ CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率 Ag2SO4 升高反应温度、适当增加硫酸的浓度(答案合理即可) 30 10 17.5 当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积
【解析】
(1)在稀硫酸中加入硫酸铜后发生了两个反应:CuSO4+Zn===ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑。
(2)由于Zn与反应生成的Cu及硫酸铜溶液组成了CuZn原电池,大大加快了生成氢气的反应速率。
(3)只要是比锌的金属性弱的金属都可以与锌组成原电池,都可以加快生成氢气的反应速率,故在所给的物质中只有Ag2SO4符合题意。
(4)要加快生成氢气的反应速率,还可以采取如下措施:升高温度、适当增大硫酸的浓度、增加锌粒的比表面积等。
(5)①因为要研究硫酸铜的量对反应速率的影响,故应保持硫酸的浓度在各组实验中相同,则硫酸溶液的体积均取30 mL,根据F中增加的水与硫酸铜溶液的体积之和为20 mL,可以求得V6=10 mL, V9=17.5 mL。
②由于析出的铜的量较多,会覆盖在锌的表面,使得锌与稀硫酸接触面积大大减小,故反应速率反而减慢。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=﹣190kJ/mol。下列说法正确的是
O2(g)=CO2(g)+2H2(g) ΔH=﹣190kJ/mol。下列说法正确的是
A.CH3OH的燃烧热为190kJ/mol
B.该反应说明CH3OH比H2稳定
C.反应中的能量变化与反应体系的温度和压强无关
D.CO2(g)+2H2(g)=CH3OH(g)+![]() O2(g) ΔH=+190kJ/mol
O2(g) ΔH=+190kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

①该反应是____反应(填“吸热”、“放热”)。
②当反应达到平衡时,升高温度,A的转化率___(填“增大”、“减小”、“不变”),原因是____。
③反应体系中加入催化剂对反应热是否有影响?____(填“有”、“无”),原因是____。
④在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1____,E2____(填“增大”、“减小”、“不变”)。
(2)已知由氢气和氧气反应生成1 mol水蒸气,放出241.8kJ热量。
①写出该反应的热化学方程式___。
②若1g水蒸气转化成液态水放热2.494kJ,则反应H2(g)+1/2O2(g)=H2O(l)的ΔH=_kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理某废水时,反应过程中部分离子浓度与反应进程关系如下图,反应过程中主要存在N2、HCO3、ClO、CNO(C+4价,N-3价)、Cl等微粒。下列说法不正确的是

A.该废水呈强酸性
B.废水处理后转化为无害物质
C.反应的离子方程式:3ClO+2CNO+H2O == N2+2HCO3+3Cl
D.每处理1 mol CNO转移3 mol e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,反应2NO+O2![]() 2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()

A.a点B.b点C.c点D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:KClO3+6HCl=KCl+3Cl2↑+3H2O。下列结论正确的是
A.氧化性:Cl2>KClO3
B.HCl作还原剂,全部被氧化
C.KClO3 作氧化剂,具有氧化性
D.生成3 mol Cl2 ,转移电子的物质的量为6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
A. c1∶c2=3∶1B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率相等D. c1的取值范围为0.04 mol·L-1 < c1 < 0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJmol-1表示。请认真观察下图,然后回答问题。

(1)图中反应是______(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)环境先提供能量,该反应的△H=_________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g) =H2O(g) △H= -241.8kJmol-1,该反应的活化能为167.2 kJmol-1,则其逆反应的活化能为__________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能_________,单位体积内活化分子的百分数________,因此反应速率_________,(前面的三个空填“增大”“减小”“不变”)你认为最可能的原因是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com