
【题目】已知反应:KClO3+6HCl=KCl+3Cl2↑+3H2O。下列结论正确的是
A.氧化性:Cl2>KClO3
B.HCl作还原剂,全部被氧化
C.KClO3 作氧化剂,具有氧化性
D.生成3 mol Cl2 ,转移电子的物质的量为6 mol
【答案】C
【解析】
根据反应可知,该反应为归中反应,反应中氯酸钾所含氯元素化合价降低,氯化氢所含氯元素有![]() 化合价升高而表现还原性,另有
化合价升高而表现还原性,另有![]() 生成氯化钾表现酸性,所以氯酸钾是氧化剂,HCl只有一部分是还原剂,氧化产物和还原产物都是Cl2,据此进行判断。
生成氯化钾表现酸性,所以氯酸钾是氧化剂,HCl只有一部分是还原剂,氧化产物和还原产物都是Cl2,据此进行判断。
A.根据分析可知:该反应的氧化剂是氯酸钾,还原产物是氯气,根据氧化还原的基本规律:氧化剂的氧化性比氧化产物强,所以有:氧化性KClO3>Cl2,A选项错误;
B.HCl有![]() 被氧化,另有
被氧化,另有![]() 表现酸性,所以B选项错误;
表现酸性,所以B选项错误;
C.氯酸钾在反应中所含氯元素化合价降低,是氧化剂,具有氧化性,C选项正确;
D.每生成3mol氯气被还原的氯酸钾为1mol,所以得电子总数为:1mol×5=5mol,转移的电子数等于得电子总数也为5mol,D选项错误;
答案选C。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乙醇燃烧是生成物总能量高于反应物总能量的反应
B. 稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3 kJ/mol可表示稀硫酸与稀Ba(OH)2溶液反应的中和热为△H=﹣57.3 kJ/mol
C. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣QkJ/mol可以表示H2S的燃烧热
D. 高温下,某反应达到平衡,平衡常数为K=![]() ,恒容时,温度升高,H2浓度减小,故该反应的焓变为正值
,恒容时,温度升高,H2浓度减小,故该反应的焓变为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X) < Mr(Y)= 0.5Mr(Z),下列说法正确的是()
A.原子数目相等的三种气体,质量最大的是Z
B.相同条件下,同质量的三种气体,气体密度最小的是X
C.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D.同温下,体积相同的两容器分别充2gY气体和1gZ气体,则其压强比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是____________________________;
(3)实验室中现有![]() 、
、![]() 、
、![]() 、
、![]() 等4中溶液,可与实验中
等4中溶液,可与实验中![]() 溶液起相似作用的是______________________________________;
溶液起相似作用的是______________________________________;
(4)要加快上述实验中气体产生的速率,还可采取的措旌有________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
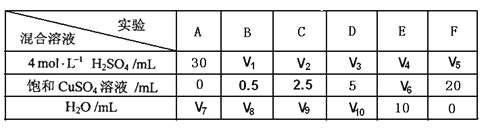
①请完成此实验设计,其中:V1=______,V6=______,V9=______;
②该同学最后得出的结论为:当加入少量![]() 溶液时,生成氢气的速率会大大提高。但当加入的
溶液时,生成氢气的速率会大大提高。但当加入的![]() 溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________
溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某炼锌厂利用含ZnO的烟尘脱除硫酸工艺烟气中的SO2制ZnSO4。
已知:Ⅰ.ZnSO3·![]() H2O微溶于水,ZnSO4易溶于水。
H2O微溶于水,ZnSO4易溶于水。
Ⅱ.25℃时,溶液中S(+4价)各组分的物质的量分数随pH变化曲线如下图。
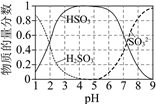
Ⅲ.O3为强氧化剂,1 mol O3被还原转移2 mol e,同时生成1 mol O2。
(1)SO2造成的环境问题主要是_____________________。
(2)ZnO将SO2转化为ZnSO3·![]() H2O的化学方程式是_____________________________。
H2O的化学方程式是_____________________________。
(3)将ZnSO3·![]() H2O悬浊液转化为ZnSO4时,因其被O2氧化的速率很慢,易造成管道堵塞,实验室模拟O3氧化解决该问题。初始时用盐酸将5% ZnSO3悬浊液调至 pH=3.5,以一定的进气流量通入O3,研究O3氧化ZnSO3·
H2O悬浊液转化为ZnSO4时,因其被O2氧化的速率很慢,易造成管道堵塞,实验室模拟O3氧化解决该问题。初始时用盐酸将5% ZnSO3悬浊液调至 pH=3.5,以一定的进气流量通入O3,研究O3氧化ZnSO3·![]() H2O,其中溶液pH随时间变化的曲线如下:
H2O,其中溶液pH随时间变化的曲线如下:

①pH=3.5的溶液中含S(+4价)的离子主要是____________________。
②一段时间后,溶液的pH减小,此过程中主要反应的离子方程式是________________。
③解释O3氧化可防止管道堵塞的原因:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用如图装置制取一定量的饱和氯水,并进行氯水的性质实验。
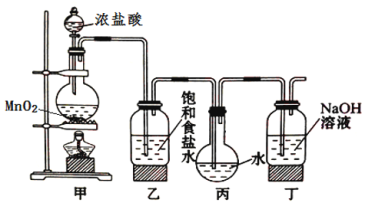
(1)在装入药品前应进行的操作____________________________________________。
(2)写出丁装置中发生反应的离子方程式:_______________________。
(3)用制得的饱和氯水分别进行下列实验:
①滴入碳酸钠溶液中,有气体生成,说明氯水中发生反应的粒子是___________;
②滴到蓝色石蕊试纸上的现象:_________________________________________。
(4)久置的氯水漂白效果明显不足或消失,用化学方程式表示:_________________。
(5)将制得的饱和氯水慢慢滴入含有酚酞的NaOH稀溶液中,当滴到一定量时,红色突然褪去。产生上述现象的原因可能有两种(简要文字说明):
①__________________________________________________________________;
②__________________________________________________________________。
用实验证明红色褪去的原因是①或者②的实验方法是:___________。
(6)科学家提出,使用氯气对自来水消毒时,氯气会与水里的有机物反应,生成的有机氯化物可能对人体有害,现已开始使用新的自来水消毒剂,如_________________(举两例,写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下四种物质 ①22g二氧化碳;②5g氢气;③1.204╳1024个氮气分子; ④4℃时18g水,它们所含分子数最多的是_________________;质量最大的是____________;常温时体积最大的是_______________ (填序号)。
(2)V L Fe2(SO4)3溶液中含Fe3+mg,则溶液中SO42-的物质的量浓度为________mol·L-1
(3)标况下,mg 气体A和ng气体B具有相等的体积,则同温同压下的密度之比为________, 同质量的A、B的分子数目之比为________。
(4)在无土栽培中,配制1 L内含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为_____________、_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,意大利科学家使用普通氧分子和带正电的氧离子作用,制造了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子。
⑴下列有关说法中,不正确的是________(填字母)。
A.O4分子内存在共价键
B.合成O4的反应可看做核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧元素的同素形体
D.O4将来可用作更强有力的火箭推进的氧化剂
⑵制备O2-、O22-甚至O22+的化合物是可能的,通常它们是在氧分子进行下图所示的各种反应时生成。这些反应中,相当于氧分子的氧化的是_______(填序号);相当于氧分子的还原的是_______(填序号)。

⑶O22+中氧原子间形成3对共用电子对使氧原子达到稳定结构,写出O22+的电子式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种神经类药物,其合成路线如下:
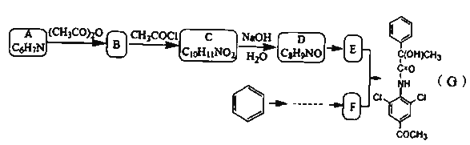
已知信息: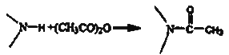 ;
;

![]()
(1)下列说法正确的是__________。
A.化合物G的分子式为![]()
B.化合物A到B的反应类型为取代反应
C.1mol化合物D最多可以与![]() 发生加成反应
发生加成反应
D.化合物D生成E的反应试剂和条件:浓氯水和铁屑
(2)A中官能团的名称是_________ C的结构简式:_________。
(3)写出E+F→G的化学方程式:__________________。
(4)写出化合物E同时符合下列条件的所有同分异构体的结构简式__________________。
①红外光谱显示含有三种官能团,其中无氧官能团与E相同,不含甲基。
②分子中含有苯环,![]() 谱显示苯环上只有一种化学环境的氢原子。
谱显示苯环上只有一种化学环境的氢原子。
③苯环上有4个取代基,能发生银镜反应。
(5)根据题中信息,设计以苯和![]() 为原料制备F的合成路线。(无机试剂任选,用流程图表示)__________
为原料制备F的合成路线。(无机试剂任选,用流程图表示)__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com