
【题目】25℃先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.lmol/L的KOH溶液以测定氯水的浓度。此过程中溶液pH变化的曲线如图所示。
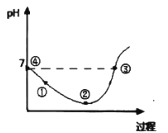
下列叙述中正确的是( )
A.滴定过程中,当水电离的c(H+)=10-7mol/L时,溶液显中性
B.滴定过程中宜选用酚酞为指示剂,不宜选用甲基橙为指示剂
C.②点的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-)
D.③点溶液中c(K+)+c(H+)=c(OH-)+c(Cl-)
【答案】C
【解析】
过程先发生反应Cl2+H2OHCl+HClO,后KOH先和HCl反应,再和HClO反应,结合分析解答。
A.滴定过程中,会出现两处水电离的c(H+)=10-7mol/L的情况,第一次溶液显中性,当HClO完全和KOH反应生成KClO时,次氯酸根离子水解使溶液显碱性,水的电离程度增大,继续滴加KOH溶液,水电离的c(H+)又会出现10-7mol/L情况,此时溶液显碱性,故A错误;
B.滴定过程中HClO、ClO-有漂白性,不宜用酚酞和甲基橙为指示剂,故B错误;
C.②点的溶液酸性最强,溶液中HClO浓度最大,HCl完全电离,HClO是弱电解质,电离程度较小,则溶液中存在c(H+)>c(Cl-)>c(HClO)>c(ClO-),故C正确;
D.③点溶液呈中性,应为KCl、KClO和HClO的混合溶液,存在电荷守恒:c(K+)+c(H+)=c(OH-)+c(Cl-)+c(ClO-),故D错误;
答案选C。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚硝酰(NOCl,沸点为-5.5℃)是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2+HNO3=AgNO3+HNO2。
(1)将5g在300℃下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002molNO2。反应12~36min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为_。氯化钾需要“干燥”的原因是__。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。

①仪器a的名称为__。
②干燥管中盛放的试剂为_。
③生成NOCl的化学方程式为__。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
步骤 | 实验现象或反应的化学方程式 |
①取5mL仪器a中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O反应的化学方程式为__ |
②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为__ |
③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为_ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计的制取溴苯的实验装置如下图所示:

装置A是酸式滴定管,分液漏斗中是苯和液溴的混合物,打开分液漏斗的活塞,使混合物滴在铁丝上(酸式滴定管活塞关闭)。请回答下列问题:
(1)A选用酸式滴定管而不用碱式滴定管的原因是___________________。
(2)A中反应的化学方程式是________________。
(3)垂直于A的导气管要做得长一些,是为了_________________。
(4)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是______________,反应的化学方程式是___________________。
(5)C中盛放四氯化碳的作用是_______________。
(6)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入硝酸银溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_____________,现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应,下列叙述中不正确的是 ( )
①放热的反应发生时不必加热 ②化学反应一定有能量变化 ③吸热反应需要加热后才能发生 ④化学反应热效应数值与参加反应的物质的量多少有关。
A. ②④B. ②③C. ①③D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)==CO2(g)+2H2O(g)△H=-890.3kJ/mol
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ/mol
2NH3(g)△H=-38.6kJ/mol
C.NaOH(s)+1/2 H2SO4(浓)==1/2Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
D.2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l)△H=-2589.6kJ/moL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2(g)(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
2NO(g)+O2(g)(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
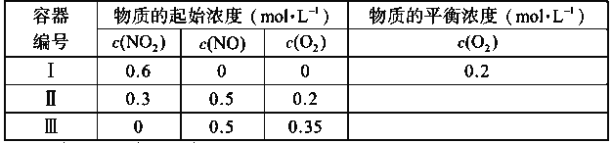
A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5
B.达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.达平衡时,容器Ⅲ中NO的体积分数小于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
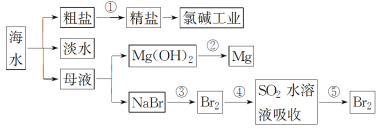
(1)过程①是为了除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,若要除去SO42-,则需要加入的试剂为_____________;若所加的该试剂过量,则可以被后加入的________________除去。
(2)过程②能否一步实现转化?______________(填“能”或“否”),Mg(OH)2与盐酸反应可以得到MgCl2溶液,则该反应的离子方程式为_____________________________________________。
(3)过程④反应的离子方程式为_____________________________________________________。
(4)若用CCl4萃取溴水中的Br2,分液时CCl4层应从分液漏斗的_____________放出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯消毒剂有多种,二氧化氯可用于自来水消毒,84消毒液用于家庭、宾馆的消毒。
I.实验室可用亚氯酸钠固体与应制备ClO2:2NaClO2+Cl2=2ClO2+2NaCl,装置如图所示:
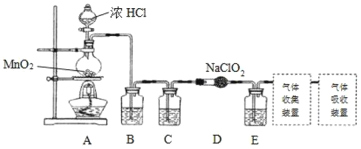
(1)装置A中,盛装浓盐酸的仪器名称为___,开始反应后,圆底烧瓶内发生的反应的离子反应方程式为:__。
(2)已知常温常压下,ClO2和Cl2是气体,在不同溶剂中溶解性如表所示:B、C、E装置中的试剂依次是___(填编号)
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 易溶 |
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.CCl4
(3)使用ClO2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。Fe2+消除ClO2-的离子方程式为__。
II.某同学在家中自制出与“84消毒液”成分(NaClO和水)相同的消毒液。主要器材有6V变压器、两支木杆铅笔、废纯净水瓶、食盐、卫生纸、绝缘胶布、小刀等。
(4)实验过程:向一个废弃的纯净水瓶中灌入大半瓶自来水,并加入3调味匙食盐,用卫生纸将用铅笔做成的电极包好,并插入纯净水瓶中,使电极恰好卡在瓶口,装置如图,接通电源后,可以看到一侧电极无明显现象,另一侧电极有细小的气泡产生,请写出该电极反应式为:___;持续通电约3小时后,发现原先无明显现象的电极附近也开始产生一定量的细小气泡,此电极此时的电极反应式___。看到该现象后停止通电。

(5)用该方法制备消毒液的总化学方程式是:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com