
����Ŀ����Ҫ��ش��������⡣
��1��Ϊ�˷�ֹFeSO4��Һ���ʣ�Ӧ����Һ�м���������_________��Ԫ�ط��ű�ʾ����
��2������ѪҺ�е��������ʲ����ڵ���ʵ���_________������ţ���ͬ����
a��H2CO3 b��������(C6H12O6)
c��NaHCO3 d��NaCl
��3������Na2CO3��NaHCO3��Һ��ѡ�õķ������Լ���_________��
a��CaCl2��Һ b����ɫ����
c��Ca(OH)2��Һ d��NaOH��Һ
��4�����б仯�У����漰������ԭ��Ӧ����_________��
a��������ұ�� b����������ʴ
c������ʯ���γ� d��ʳ��ı���
��5�����й��̱����������������ʵ�ֵ���_________��
a��Cl2��ClO�� b��NH3��NH����
c��KMnO4��MnO2 d��Fe2����Fe3��
��6��������ͬ���������ۣ��ֱ���������������NaOH��Һ���ų���H2��ͬ��ͬѹ�����֮��Ϊ__________________��
��7���������������صĽᾧˮ���KAl(SO4)2��12H2O����һ�ֳ������Ӽ���������ˮ���ܵ�������ֽ������Ӻ�������ӡ�д���������ص��뷽��ʽ��_____________________________________________��
���𰸡�Fe b a c d 1:1 KAl(SO4)2��K����Al3����2SO42��
��������
��1��Fe2+�ױ������е�����������Fe3+����Fe�ܽ��仹ԭ��2Fe3++Fe=3 Fe2+��
��2��������������ܵ���Ļ�����ɸ������ʵ�������ܷ�����жϸ������Ƿ�Ϊ����ʡ�
��3��̼������ܣ�̼����ƿ��ܣ���Ԫ����ɫ��ӦΪ��ɫ���������״̬�أ�Ca(OH)2��Һ��NaHCO3��Ӧ�Ƚϸ��ӣ�Ca(OH)2+ NaHCO3(��)![]() CaCO3��+ H2O+ NaOH��Ca(OH)2+ 2NaHCO3(��)
CaCO3��+ H2O+ NaOH��Ca(OH)2+ 2NaHCO3(��)![]() CaCO3�� + 2H2O+Na2CO3������������Զ��٣����ܲ���CaCO3������
CaCO3�� + 2H2O+Na2CO3������������Զ��٣����ܲ���CaCO3������
��4���Ƿ���������ԭ��Ӧ�ɸ�������Ԫ�ػ��ϼ��Ƿ����ı����жϡ�
��5���������������ķ�Ӧ��������Ӧ��b��NH3��![]() ��c��KMnO4��MnO2�������ϣ�����Ԫ�ػ��ϼ�ֻ�����������ʣ���������������ܷ���������Ӧ�������ɷ����绯��Ӧ����Fe2+���ܷ����绯��Ӧ���������Ϸ����ɶԱ�С�������жϡ�
��c��KMnO4��MnO2�������ϣ�����Ԫ�ػ��ϼ�ֻ�����������ʣ���������������ܷ���������Ӧ�������ɷ����绯��Ӧ����Fe2+���ܷ����绯��Ӧ���������Ϸ����ɶԱ�С�������жϡ�
��6��������ԭ��Ӧ�ĺ����ǵ��ӵ�ʧ�غ㣬������һԭ���ɼ��йؼ��㡣
��7�����������Σ���ˮ����ȫ���룬��������Ϣ������д�����뷽��ʽ��
��1������������Һ������Ҫ���������ӱ������е���������������Fe���ɷ�ֹ�������ӱ������� 2Fe3��+Fe= 3Fe2�������Դ�Ϊ��Fe��
��2��̼�����ᣬNaHCO3���Ȼ������Σ����Ƕ����ڵ���ʣ������Dz��ܵ��룬���ڷǵ���ʣ����Դ�Ϊ��b��
��3��̼������ܣ�̼����ƿ��ܣ����Կ����Ȼ�����Һ����Na2CO3��NaHCO3��Һ�����߾�����Ԫ�أ���ɫ��Ӧ��Ϊ��ɫ�����Բ�������ɫ��Ӧ����Ca(OH)2��Һ�еĸ���������Na2CO3��Һ�е�̼��������γ�̼��Ƴ�����Ca(OH)2+ Na2CO3![]() CaCO3��+ 2NaOH��Ca(OH)2��Һ�е�OH-����NaHCO3�е�
CaCO3��+ 2NaOH��Ca(OH)2��Һ�е�OH-����NaHCO3�е�![]() ����
����![]() �����ɵ�
�����ɵ�![]() �ܽ�һ����Ca2+���ɳ��������Բ�����Ca(OH)2����Na2CO3��NaHCO3��Һ��NaOH��Һ��Na2CO3��Һ��ϲ���Ӧ��������������NaHCO3���ܷ�Ӧ�����������������Դ�Ϊ��a��
�ܽ�һ����Ca2+���ɳ��������Բ�����Ca(OH)2����Na2CO3��NaHCO3��Һ��NaOH��Һ��Na2CO3��Һ��ϲ���Ӧ��������������NaHCO3���ܷ�Ӧ�����������������Դ�Ϊ��a��
��4��������ұ��һ���ǽ�����Ԫ�شӻ���̬ת�������̬���л��ϼ۵ı仯����������������ԭ��Ӧ��������ʴ�ı�����Fe������������ʯ���γɹ���Ϊ��CaCO3+H2O +CO2=Ca(HCO3)2��Ca(HCO3)2=CaCO3��+ H2O+ CO2�������漰������ԭ��Ӧ��ʳ��ı���ԭ�����ʳ�ﱻ���������Դ�Ϊ��c��
��5��Cl2����NaOH��Һ����ClO-��Cl2+2OH-=Cl-+ClO-+H2O�����绯��Ӧ������������������NH3��![]() û�л��ϼ۵ı仯�����������������KMnO4��MnO2�ǻ�ԭ��Ӧ���������������Fe2����Fe3����Fe���ϼ����ߣ���������������Ӧ������������������Դ�Ϊ��d��
û�л��ϼ۵ı仯�����������������KMnO4��MnO2�ǻ�ԭ��Ӧ���������������Fe2����Fe3����Fe���ϼ����ߣ���������������Ӧ������������������Դ�Ϊ��d��
��6��Al�����������ỹ����NaOH��Һ��Ӧ����H2����span>Alʧ���ӡ�H�õ��ӡ����ݵ��ӵ�ʧ�غ��֪����ͬ��Alʧ��������ͬ�������ɵ�H2Ҳ��ͬ�����Դ�Ϊ��1��1��
��7���������⣬�������������K����Al3����![]() �����뷽��ʽΪ��KAl(SO4)2��K����Al3����2
�����뷽��ʽΪ��KAl(SO4)2��K����Al3����2![]() �����Դ�Ϊ��KAl(SO4)2��K����Al3����2
�����Դ�Ϊ��KAl(SO4)2��K����Al3����2![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º��������£����������в��ǿ��淴Ӧ2A��g��+3B��s��![]() 2C��g���ﵽƽ��ı�־���ǣ� ��
2C��g���ﵽƽ��ı�־���ǣ� ��
��C������������C�ķֽ�������ȣ��ڵ�λʱ������amol A��ͬʱ����1.5amol B���۸���ֵ�Ũ�Ȳ��ٱ仯���ܻ��������ܶȲ��ٱ仯���ݻ���������ѹǿ���ٱ仯�������������ʵ������ٱ仯����������ƽ��Ħ���������ٱ仯����A��B��C�ķ�����Ŀ��Ϊ2��3��2��
A. �ݢޢ�B. �ڢݢ�C. �٢ۢ�D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.���³�ѹ�£�3.2 g O2��O3�Ļ�������к�����ԭ�ӵ���ĿԼΪ0.2��6.02��1023
B.1 L 0.5 mol��L1 CH3COONa��Һ�к���CH3COOH��CH3COO������ԼΪ0.5��6.02��1023
C.��״���£�1.12 L HCl�����к��е��ӵ���ĿԼΪ0.9��6.02��1023
D.0.1mol�������飨![]() ���к��й��ۼ�������ԼΪ0.3��6.02��1023
���к��й��ۼ�������ԼΪ0.3��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ƚ���ʹ�õĽ���֮һ������������⣺
�������ӹ�ҵ����30%��FeCl3 ��Һʴ��ͭ�������·��Ĺ����У���Һ��������Դ���յĹ�����ͼ��ʾ��

��1��FeCl3 ��Һʴ��ͭ����Ӧ�����ӷ���ʽΪ��___________________________��
��2����Һ�д��ڽ϶����������____________________��
��3�������Լ�Ҳ��������������ת�������ѡ�õ���________������ţ���
a������KMnO4��Һ b����ˮ c��H2O2 ��Һ
����ij�Ȼ�����Ʒ�к�������FeCl2���ʣ���Ҫ�ⶨ������Ԫ�ص�����������ʵ�鲽�����£�
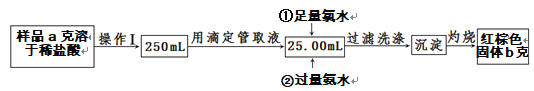
��4�����������õ��IJ����������ձ����������⣬��������_________________________�����������ƣ���
��5��д���ڼ��������ˮ�����ӷ���ʽ��_____________________��
��6����Ʒ����Ԫ�ص���������Ϊ________________��
��7�����������ղ���֣������ղ��������Ӱ�죺________________������ƫ������ƫС��������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A.Al(OH)3����������NaOH��Һ��Al(OH)3��OH����AlO2����2H2O
B.Na2O2��H2O��Ӧ��Na2O2��H2O��2Na����2OH����O2��
C.������ˮ�ķ�Ӧ��Cl2��H2O��2H����Cl����ClO��
D.�����еμӰ�ˮ��H����OH����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ͨ�����з�Ӧ�����Ʊ������մɵ�ԭ��MgO�� MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) ��H>0���÷�Ӧ�ں��ݵ��ܱ������дﵽƽ��������ı�ͼ�к�����x��ֵ�����´ﵽƽ���������y��x�仯���ƺ�������
MgO(s) + CO2(g) +SO2(g) ��H>0���÷�Ӧ�ں��ݵ��ܱ������дﵽƽ��������ı�ͼ�к�����x��ֵ�����´ﵽƽ���������y��x�仯���ƺ�������

ѡ�� | x | y |
A | �¶� | �����ڻ��������ܶ� |
B | CO�����ʵ��� | CO2��CO�����ʵ���֮�� |
C | SO2��Ũ�� | ƽ�ⳣ��K |
D | MgSO4����������������� | CO��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ȼ���е������٣���;�dz��㷺��ͨ���Ի����Ϊԭ����ȡ�����飬����������ͼ��ʾ��

��֪���ٻ������Ҫ�ɷ���Bi2S3����������Bi2O3��SiO2�����������������ȡ�
��Bi2O3�������ᣬNaBiO3������ˮ��
�۳����£�Ksp[Fe(OH)3]=4��10-38,Ksp[Bi (OH)3]=4��10-30��Ksp[Fe(OH)2]=8.0��10-16��
�ش��������⣺
��1��д���������ʱBi2S3�����������ʵĻ�ѧ����ʽ_______________��
��2������1�ijɷ�Ϊ_______________��
��3�����Ӽ�������a.������ҺpH,b_______________��д��һ������߲�������ij��Ӽ�_______________��
��4����Һ2���������Ʊ�NaBiO3,������Һ2�м���NaOH��NaClO��Һ��ȡNaBiO3,д���÷�Ӧ�����ӷ���ʽ_______________��
��5����Һ2���õ�ⷨ��ȡ�����鵥�ʣ��������ﴦ����ɼ���ѭ��ʹ�ã����װ����ͼ��ʾ��

�ٽ���Ĥ����Ϊ_______________���Cl-����OH-��)����Ĥ��
�������缫��ӦʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Fe2(SO4)3��Һ��������ȷ����
A.����Һ��K����Fe2����SCN����Br�����Դ�������
B.��KI��Һ��Ӧ�����ӷ���ʽ��Fe3����2I��===Fe2����I2
C.��Ba(OH)2��Һ��Ӧ�����ӷ���ʽ��Fe3����SO42-��Ba2����3OH��==Fe(OH)3����BaSO4��
D.1 L 0.1 mol��L��1����Һ��������Zn��ַ�Ӧ������11.2 g Fe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������У���ij��̼ԭ���������ĸ���ͬ��ԭ�ӻ�ԭ����ʱ������̼ԭ�ӳ�Ϊ������̼ԭ�ӡ������磬�����л�������д���*��̼ԭ�Ӿ�������̼ԭ�ӡ����л���ֱ������з�Ӧ�����ɵ��л���������Ժ�������̼ԭ�ӵ���

A. ��������Һ���÷���������ӦB. ������������![]() ��Ӧ
��Ӧ
C. �����ᷢ��������ӦD. ��NaOH��Һ���������·�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com