
【题目】铁是人类比较早使用的金属之一。完成下列问题:
Ⅰ.电子工业中用30%的FeCl3 溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程如图所示。

(1)FeCl3 溶液蚀刻铜箔反应的离子方程式为:___________________________;
(2)滤液中存在较多的阳离子是____________________;
(3)以下试剂也可以替代氯气完成转化,最好选用的是________(填序号)。
a.酸性KMnO4溶液 b.溴水 c.H2O2 溶液
Ⅱ.某氯化铁样品中含有少量FeCl2杂质,现要测定其中铁元素的质量分数,实验步骤如下:
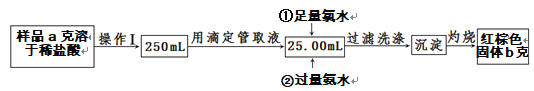
(4)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_________________________(填仪器名称)。
(5)写出②加入过量氨水的离子方程式:_____________________。
(6)样品中铁元素的质量分数为________________。
(7)若沉淀灼烧不充分,对最终测量结果的影响:________________(填“偏大”“偏小”或“无影响”)。
【答案】2Fe3++Cu=2Fe2++Cu2+ Fe2+ c 250 mL容量瓶、胶头滴管 Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ ![]() ×100% 偏大
×100% 偏大
【解析】
I.氯化铁溶液蚀刻铜箔所得废液中含有的金属离子有Fe2+、Fe3+和Cu2+,加入过量铁粉,溶液变为氯化亚铁溶液,过滤后的滤液通入足量氯气便可转化成氯化铁溶液,再经一系列分离操作可获得无水氯化铁;而固体为含有铁粉的铜,将铁粉除去便可获得铜单质。
II.要测定含氯化亚铁杂质的氯化铁样品中铁元素的质量分数,依据图示方法为:取一定质量的样品,先用足量的氯水氧化,再用过量氨水沉淀为氢氧化铁沉淀,过滤洗涤后的沉淀经灼烧最终转化成氧化铁,通过氧化铁的质量就可以计算出原样品中铁元素的质量分数。据此解答各小题。
I(1)氯化铁能将铜氧化:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+。
(2)由于废液中加入的铁粉是过量的,所以原溶液中的Cu2+和Fe3+均被还原,溶液中的金属阳离子只剩下Fe2+,故答案为:Fe2+。
(3)代替氯气将氯化亚铁氧化成氯化铁的物质不应带入杂质,所列三种物质均能将Fe2+氧化成Fe3+,但酸性高锰酸钾溶液和溴水均会带入杂质,而过氧化氢的还原产物水不是杂质,所以最好选用过氧化氢溶液,故答案为:c。
II(4)操作I是将溶液稀释成250mL,所用到的玻璃仪器有:250mL容量瓶、烧杯、玻璃棒、胶头滴管。故答案为:250mL容量瓶、胶头滴管。
(5)经氯水氧化后的溶液为氯化铁溶液,加氨水发生的反应为:Fe3++3NH3·H2O=Fe(OH)3↓+3![]() 。故答案为:Fe3++3NH3·H2O=Fe(OH)3↓+3
。故答案为:Fe3++3NH3·H2O=Fe(OH)3↓+3![]() 。
。
(6)bgFe2O3中铁的物质的量为:![]() =
=![]() mol,由于只取了250mL溶液中的25mL,所以,根据铁元素守恒,样品中铁元素的质量分数为:
mol,由于只取了250mL溶液中的25mL,所以,根据铁元素守恒,样品中铁元素的质量分数为: =
=![]() ×100%。故答案为:
×100%。故答案为:![]() ×100%。
×100%。
(7)氢氧化铁固体灼烧的反应为:2Fe(OH)3 ![]() Fe2O3+3H2O,灼烧过程中固体质量减少,如果灼烧不充分,会使所测氧化铁的质量偏高,从而使计算出的铁的含量偏大。故答案为:偏大。
Fe2O3+3H2O,灼烧过程中固体质量减少,如果灼烧不充分,会使所测氧化铁的质量偏高,从而使计算出的铁的含量偏大。故答案为:偏大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】我国科研人员在钠离子电池研究中又取得新突破。钠离子电池与锂离子电池工作原理相同、制造工艺相似,而且具有资源丰富、成本低廉、安全性能好等特点。一种钠离子电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解质溶液为的碳酸丙烯酯溶液。
回答下列问题:
(1)基态Na原子的电子排布式为__,最高能层电子云轮廓图形状为___。
(2)Te与S同主族,与![]() 同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。
同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。
(3)碳酸丙烯酯的结构简式为![]() ,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。
,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。
(4)C元素的最高价氧化物的电子式为___,CO32-的VSEPR模型名称是___,ClO4-的立体构型是__。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是__,该配离子包含的作用力为___(填选项字母)。
A.极性键 B.金属键 C.氢键 D.配位键
(6)由原料制备负极材料的反应过程中,是否有电子转移___(填“是”或者“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氮气和水蒸气为原料,电化学合成氨装置(电极不参与反应)示意图如下。下列说法不正确的是

A.电极a连接电源的正极B.OH向电极a迁移
C.电极b的电极反应:N2+6e+6H+= 2NH3D.总反应:2N2+6H2O(g)![]() 4NH3+3O2
4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究1,3-丁二烯和Br2以物质的量之比为1∶1加成时的反应:
![]() ;
;![]()
文献:Ⅰ.一般情况,在相同条件下,化学反应的活化能(E)越大,化学反应速率越小。
Ⅱ.1,3-丁二烯和Br2以物质的量之比为1∶1加成时的反应过程和能量变化的示意图如下:

(1)已知:
![]() ΔH1=-a(a>0) kJ·mol1 ;
ΔH1=-a(a>0) kJ·mol1 ; ![]() ΔH2=+c(c>0) kJ·mol1
ΔH2=+c(c>0) kJ·mol1
①稳定性:A ______ B(填“>”、“=”或“<”)。
②气态1,3-丁二烯和液态Br2以物质的量之比为1∶1加成生成液态B的热化学方程式是______。
(2)探究1,2-加成和1,4-加成的影响因素。
实验1 将1,3-丁二烯和Br2以物质的量之比1∶1加成,不同温度,相同时间内测定A和B在产物中的含量,低温时产物以A为主,较高温时以B为主。
实验2 加热实验1中低温时的反应产物,A的含量减少,B的含量增大。
实验3 在实验1的基础上,充分延长反应时间,无论是低温还是高温,产物中B的含量均增大。
①结合反应过程和能量变化的示意图,解释实验1中低温时产物以A为主的原因:______。
②说明实验2中,升高温度,A转化为B经历的物质转化过程:______。
③综上所述,有利于1,4加成的措施是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)为了防止FeSO4溶液变质,应在溶液中加入少量的_________(元素符号表示)。
(2)人体血液中的下列物质不属于电解质的是_________(填序号,下同)。
a.H2CO3 b.葡萄糖(C6H12O6)
c.NaHCO3 d.NaCl
(3)区分Na2CO3和NaHCO3溶液可选用的方法或试剂是_________。
a.CaCl2溶液 b.焰色试验
c.Ca(OH)2溶液 d.NaOH溶液
(4)下列变化中,不涉及氧化还原反应的是_________。
a.金属的冶炼 b.钢铁的锈蚀
c.钟乳石的形成 d.食物的变质
(5)下列过程必须加入氧化剂才能实现的是_________。
a.Cl2→ClO- b.NH3→NH4+
c.KMnO4→MnO2 d.Fe2+→Fe3+
(6)质量相同的两份铝粉,分别放入足量的盐酸和NaOH溶液,放出的H2在同温同压下体积之比为__________________。
(7)明矾〔硫酸铝钾的结晶水合物:KAl(SO4)2·12H2O〕是一种常用添加剂,明矾在水中能电离出两种金属离子和酸根离子。写出硫酸铝钾电离方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示。下列说法正确的是

A.Y电极反应为Pb+SO42--2e-=PbSO4
B.每消耗103.5gPb, 理论上电解池阴极上有1molH2生成
C.该电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.若污水为含有Cr2O72-工业酸性废水,为将其转化为Cr3+除去,可让铁电极连接铅蓄电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜是一种附加值较高的铜类物质,下列流程是利用再生资源回收高品质氧化亚铜。某兴趣小组通过查阅资料得知CuCI可溶于![]() 浓度较大的体系,能被硝酸氧化,在碱性条件下易水解转化为
浓度较大的体系,能被硝酸氧化,在碱性条件下易水解转化为![]() ,
,![]() 在酸性条件下可歧化为
在酸性条件下可歧化为![]() 和Cu。据此设计了如下实验方案。下列说法正确是( )
和Cu。据此设计了如下实验方案。下列说法正确是( )

A.生成CuCl的离子方程式为![]()
B.为确保![]() 完全沉淀,应向含铜废液中加入过量的NaCl
完全沉淀,应向含铜废液中加入过量的NaCl
C.检验制得的![]() 中是否含有CuCl,可用硝酸银和硝酸
中是否含有CuCl,可用硝酸银和硝酸
D.可直接向含铜废液中加入葡萄糖,在碱性条件下制得![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com