
����Ŀ��������ͭ��һ�ָ���ֵ�ϸߵ�ͭ�����ʣ���������������������Դ���ո�Ʒ��������ͭ��ij��ȤС��ͨ���������ϵ�֪CuCI������![]() Ũ�Ƚϴ����ϵ���ܱ������������ڼ�����������ˮ��ת��Ϊ
Ũ�Ƚϴ����ϵ���ܱ������������ڼ�����������ˮ��ת��Ϊ![]() ��
��![]() �����������¿��绯Ϊ
�����������¿��绯Ϊ![]() ��Cu���ݴ����������ʵ�鷽��������˵����ȷ�ǣ� ��
��Cu���ݴ����������ʵ�鷽��������˵����ȷ�ǣ� ��

A.����CuCl�����ӷ���ʽΪ![]()
B.Ϊȷ��![]() ��ȫ������Ӧ��ͭ��Һ�м��������NaCl
��ȫ������Ӧ��ͭ��Һ�м��������NaCl
C.�����Ƶõ�![]() ���Ƿ���CuCl������������������
���Ƿ���CuCl������������������
D.��ֱ����ͭ��Һ�м��������ǣ��ڼ����������Ƶ�![]()
���𰸡�A
��������
������ͼ��֪�Ƚ���ͭ��ҺͨSO2��NaCl��Ӧ����CuCl���ٿ����¶Ⱥ�pHʹ��ˮ��ת��ΪCu2O���ݴ˻ش�
A. ����CuCl�����ӷ���ʽΪ![]() ����A��ȷ��
����A��ȷ��
B. NaCl��������CuCI������![]() Ũ�Ƚϴ����ϵ����Cu+������ȫ��������B����
Ũ�Ƚϴ����ϵ����Cu+������ȫ��������B����
C. �����Ƶõ�![]() ���Ƿ���CuCl�������������������ᣬ��Ϊ
���Ƿ���CuCl�������������������ᣬ��Ϊ![]() �����������»��绯Ϊ
�����������»��绯Ϊ![]() ��Cu����ɫ��Cu�Ḳ�ǰ�ɫ����AgCl����C����
��Cu����ɫ��Cu�Ḳ�ǰ�ɫ����AgCl����C����
D. ֱ����ͭ��Һ�м��������ǣ��ڼ����������Ƶ�![]() ,�Ậ�н϶��������������п�����������ȣ���D����
,�Ậ�н϶��������������п�����������ȣ���D����
�ʴ�ѡ��A��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ƚ���ʹ�õĽ���֮һ������������⣺
�������ӹ�ҵ����30%��FeCl3 ��Һʴ��ͭ�������·��Ĺ����У���Һ��������Դ���յĹ�����ͼ��ʾ��

��1��FeCl3 ��Һʴ��ͭ����Ӧ�����ӷ���ʽΪ��___________________________��
��2����Һ�д��ڽ϶����������____________________��
��3�������Լ�Ҳ��������������ת�������ѡ�õ���________������ţ���
a������KMnO4��Һ b����ˮ c��H2O2 ��Һ
����ij�Ȼ�����Ʒ�к�������FeCl2���ʣ���Ҫ�ⶨ������Ԫ�ص�����������ʵ�鲽�����£�
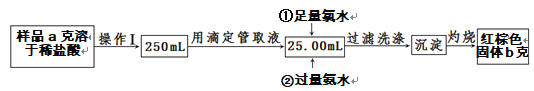
��4�����������õ��IJ����������ձ����������⣬��������_________________________�����������ƣ���
��5��д���ڼ��������ˮ�����ӷ���ʽ��_____________________��
��6����Ʒ����Ԫ�ص���������Ϊ________________��
��7�����������ղ���֣������ղ��������Ӱ�죺________________������ƫ������ƫС��������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Fe2(SO4)3��Һ��������ȷ����
A.����Һ��K����Fe2����SCN����Br�����Դ�������
B.��KI��Һ��Ӧ�����ӷ���ʽ��Fe3����2I��===Fe2����I2
C.��Ba(OH)2��Һ��Ӧ�����ӷ���ʽ��Fe3����SO42-��Ba2����3OH��==Fe(OH)3����BaSO4��
D.1 L 0.1 mol��L��1����Һ��������Zn��ַ�Ӧ������11.2 g Fe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ����٤��������ֵ������������ȷ����
A.![]() ��
��![]() ��Һ����������Ũ�ȵĵ�
��Һ����������Ũ�ȵĵ�![]() ��Һ��Ϻ���Һ��
��Һ��Ϻ���Һ��![]() ����ĿΪ1/3NA
����ĿΪ1/3NA
B.4��6g�Ҵ������к��е�̼�����ĿΪ0.5NA
C.2��1g DTO�к��е�������ΪNA
D.���³�ѹ�£�0��5mol��Ƭ������Ũ�����ϣ�ת�Ƶ�����Ϊ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ��س�Ϊ�ҹ��綯����������Դ����缫���Ͽɱ�ʾΪ![]() ����
����![]() �����ʱ����ܷ�ӦΪ��
�����ʱ����ܷ�ӦΪ��![]() �����ع���ԭ����ͼ������֮����һ�������ض�����Xͨ���ĸ�Ĥ������˵����ȷ��
�����ع���ԭ����ͼ������֮����һ�������ض�����Xͨ���ĸ�Ĥ������˵����ȷ��

A.���ʱ��AΪ������![]() ������
������
B.��������Xͨ���ĸ�Ĥ���������ӽ���Ĥ
C.�ɴ������ķϾɵ�ص�ʯī�缫�л��մ��������
D.�ŵ�ʱ��������ӦʽΪ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)1.00 L 1.00 mol��L-1H2SO4��Һ��2.00 L 1.00 mol��L-1 NaOH��Һ��ȫ��Ӧ,�ų�114.6 kJ����,�÷�Ӧ���к�����HΪ___,��ʾ���к��ȵ��Ȼ�ѧ����ʽΪ_______________��
(2)��25 ����101 kPaʱ,1.00 g C6H6(l)ȼ������CO2(g)��H2O(l),�ų�41.8 kJ������,C6H6��ȼ����Ϊ____kJ��mol-1,�÷�Ӧ���Ȼ�ѧ����ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������У���ij��̼ԭ���������ĸ���ͬ��ԭ�ӻ�ԭ����ʱ������̼ԭ�ӳ�Ϊ������̼ԭ�ӡ������磬�����л�������д���*��̼ԭ�Ӿ�������̼ԭ�ӡ����л���ֱ������з�Ӧ�����ɵ��л���������Ժ�������̼ԭ�ӵ���

A. ��������Һ���÷���������ӦB. ������������![]() ��Ӧ
��Ӧ
C. �����ᷢ��������ӦD. ��NaOH��Һ���������·�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������( GaN)������SGоƬ�IJ��ϣ�������LED�ƿɷ�������⡣�ش��������⣺
(1) Ga�ļ۵����Ų�ʽΪ____���û�̬ԭ��ռ������ܼ��ĵ���������ͼ��״Ϊ________��
����״̬�����У�����������һ����������������С����____������ĸ����
![]()
(2)8 -�ǻ�����������ڷ�����ϼ����Ӵ�����ϣ�����LiAlH4�� �ϳɡ�LiAlH4�������ӵĿռ乹��Ϊ_____________��
�ϳɡ�LiAlH4�������ӵĿռ乹��Ϊ_____________�� ����Ԫ���е縺��������____����Ԫ�ط��ţ���N���ӻ���ʽΪ________________
����Ԫ���е縺��������____����Ԫ�ط��ţ���N���ӻ���ʽΪ________________
(3)��������Al��Ga���۵�ֱ�Ϊ660����30����Al��Ga�۵�ߵ�ԭ����____________
(4)������Ϊ�����������ṹ����ͼ��ʾ���þ����ܶ�Ϊ��g/cm3����������a=b��c����λ��pm)��a��b�н�Ϊ120���������ӵ�������ֵΪNA��������c=____pm���ú�a������NA�Ĵ���ʽ��ʾ����

(5)�����������У��뾧����Խ��ߴ�ֱ�����ھ���ѧ�г�Ϊ(1��1��1)���档����ͼ��������������(1��1��1)���湲��____����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪZn-Cuԭ��ص�ʾ��ͼ����ش�

��1��пƬΪԭ��ص�_____����ͭƬΪԭ��ص�____���������������
��2��п�缫��Ӧʽ��_______������______��Ӧ�����������ԭ������ͭ�缫��Ӧʽ��______������______��Ӧ��ͬ�ϣ���
��3��______������ӡ�����������пƬͨ����������ͭƬ����Һ��H+��______���пƬ����ͭƬ������õ��ӡ�
��4����пƬ����0.1mol������һ���ų���������ʵ���Ϊ_____mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com