
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
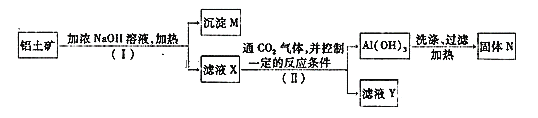
(1)I和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为_________________。
【答案】过滤 Fe2O3 2Al(OH)3![]() Al2O3+3H2O NaAlO2 盐 氨水 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
Al2O3+3H2O NaAlO2 盐 氨水 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
(1)实现固体和液体的分离用过滤的方法;
(2)根据流程图来确定发生的反应以及各种物质;
(3)根据流程图来确定发生的反应以及各种物质;
(4)氢氧化铝不溶于弱碱,AlCl3溶液中加入氨水可以制取氢氧化铝。
Al2O3、Fe2O3、SiO2中加入浓的氢氧化钠溶液时,其中的Al2O3、SiO2会与之发生反应分别生成NaAlO2和Na2SiO3的水溶液,即为滤液X,所以沉淀M主要是Fe2O3,NaAlO2和过量的CO2反应生成Al(OH)3沉淀和NaHCO3,Na2SiO3和过量的CO2反应生成NaHCO3和H2SiO3沉淀。
(1)分离溶液和沉淀的操作是过滤;
(2)沉淀M除含有泥沙外,主要是Fe2O3,Al(OH)3受热易分解生成Al2O3和H2O,所以固体N是Al2O3。Al(OH)3受热易分解的化学方程式为:2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
(3)滤液X中,含铝元素的溶质是偏铝酸钠,化学式为NaAlO2,由金属阳离子Na+和酸根离子AlO2-组成,因此该物质属于盐类;
(4)Al(OH)3是两性氢氧化物,可以与强酸、强碱发生反应,所以在实验室里常往AlCl3溶液中加入氨水可以制取氢氧化铝,氢氧化铝不溶于弱碱,反应原理为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。


科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
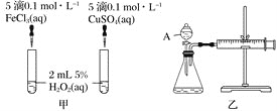
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
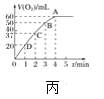
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中短周期的一部分,若A原子最外层的电子数比次外层少3,则下列说法正确的是( )
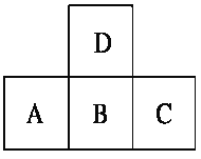
A. 原子半径的大小顺序是C > B > A > D
B. B、D之间只能形成一种化合物
C. 只有A的单质存在同素异形体
D. A、B、C的最高价氧化物对应水化物的酸性强弱的关系是C > B > A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeS2![]() SO2
SO2![]() H2SO4
H2SO4
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
D.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20 g·mL-1。
(1)此浓盐酸中HCl的物质的量浓度是________。
(2)配制100 mL该浓盐酸,需要标准状况下HCl的体积为________。
(3)配制100 mL 3.00 mol·L-1的盐酸,需以上浓盐酸的体积为________。
(4)将10.0 mL 3.00 mol·L-1的盐酸与10.0 mL 1.00 mol·L-1的MgCl2溶液混合,则混合溶液中Cl-的物质的量浓度是________。(设混合后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应 2X(g)![]() Y(g)+Z(g)的速率影响因素,在不同条件下进行 4 组实验,Y、Z 起始浓度为 0,反应物X 的浓度随反应时间的变化情况如图所示。下列说法不正确的是
Y(g)+Z(g)的速率影响因素,在不同条件下进行 4 组实验,Y、Z 起始浓度为 0,反应物X 的浓度随反应时间的变化情况如图所示。下列说法不正确的是

A. 比较实验②、④得出:升高温度,化学反应速率加快
B. 比较实验①、②得出:增大反应物浓度,化学反应速率加快
C. 若实验②、③只有一个条件不同,则实验③使用了催化剂
D. 在 0~10min 之间,实验③的平均速率 v(Y)=0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X、Y、Z是三种常见元素,X原子核内只有一个质子,Y原子的最外层电子数是次外层的三倍,且X、Y、Z均能形成中学常见的双原子气体单质,并有如下转化关系:
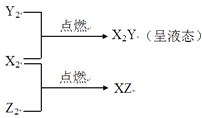
请回答下列问题:
(1)写出Y2的化学式____________。
(2)X2分别在Y2、Z2中点燃时火焰的颜色是________、_________。
(3)Z2与X2Y反应生成两种酸,其化学方程式为 ___________________。
(4)Z2与NaOH溶液反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Cu2S投入到足量浓硝酸中,收集到气体nmol,向反应后的溶液(存在Cu2+和SO42-)中加入足量NaOH,产生蓝色沉淀,过滤、洗涤、灼烧,得到CuO48.0g,若上述气体为NO和NO2混合物,且体积比为1:2。则n为( )
A.3.28B.1.80C.0.80D.1.63
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_______。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为__________________(不写反应条件),原子利用率是______________。
(3)属于乙醇的同分异构体的是_______(选填编号)。
A.![]() B.
B.![]() C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗_______mol氧气。
② 乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com