
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeS2![]() SO2
SO2![]() H2SO4
H2SO4
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
D.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、CO32-
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol SiO2中含有Si-O键为4NA
B.1 mol氢氧化铁胶粒所含氢氧化铁的分子数为NA
C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D.足量的Fe和1mol Cl2完全反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C.H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是多少______?
(2)求此化合物的分子式______?(要有简单计算过程)
(3)该化合物1分子中存在1个苯环和1个羟基,试写出它的同分异构体的结构简式______。(计算要有文字说明过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
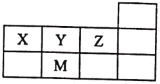
A. 原子半径:M>Z>Y>X
B. Z的气态氢化物最稳定,因其分子间存在氢键
C. 最高价氧化物对应水化物的酸性M<Z
D. 元素的非金属性:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为四种可溶性盐,它们的阳离子分别是Ba2+、Ag+、Na+、Cu2+中的一种,阴离子分别是NO![]() 、SO
、SO![]() 、Cl-、CO
、Cl-、CO![]() 中的一种(离子在物质中不能重复出现)。现做如下实验:
中的一种(离子在物质中不能重复出现)。现做如下实验:
①把四种盐分别溶于盛有蒸馏水的四支试管中,只有C的溶液呈蓝色;
②向①的四支试管中分别加入盐酸,B的溶液中有沉淀生成,D的溶液中有无色无味的气体逸出。
根据①②实验现象回答下列问题。
(1)写出A、C的化学式:A________________,C_______________。
(2)写出盐酸与D反应的离子方程式:_________________________。
(3)写出C与Ba(OH)2溶液反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
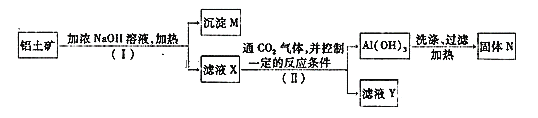
(1)I和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
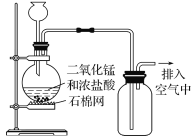
【题目】Cl2是中学化学重要气体之一,实验室常用二氧化锰与浓盐酸反应制取Cl2。请回答下列问题:
Ⅰ实验室用二氧化锰制取Cl2的化学方程式为______________________________,如图所示制取氯气装置中至少存在_____________明显错误。
Ⅱ实验室也可用高锰酸钾与浓盐酸反应制取Cl2,并收集和检验Cl2的性质。
已知:①KMnO4在不加热的条件下可与浓盐酸发生反应制取Cl2。
②无水CaCl2可吸收水蒸气。
(1)将反应原理补充完整:2KMnO4+16HCl(浓)=________+5Cl2↑+8H2O。
(2)选择实验装置,完成相应的实验:
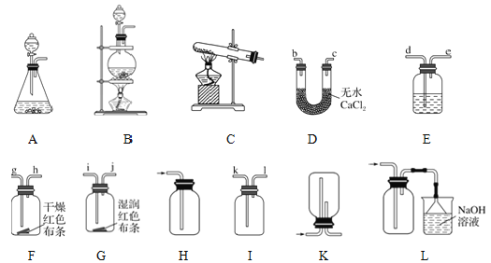
①若制取、收集干燥纯净的Cl2,按装置连接顺序可以选择其中的______(填序号)进行实验。
②若按A-E-D-F-G-L顺序连接装置进行实验,可得出的实验结论是___________。
③在上述实验①和②中,制取氯气前必须进行的一项操作是______,装置E中的试剂是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以孔雀石[主要成分是CuCO3·Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2]为原料制备CuSO4·5H2O步骤如下:
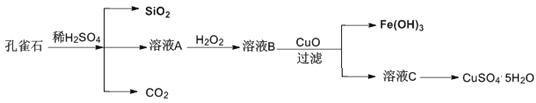
请回答下列问题:
(1)溶液A的金属离子有Fe3+和______________。
(2)溶液A中加入H2O2的目的是______________,发生的离子方程式为_____________________。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、______________、过滤等操作。
(4)溶液B与CuO反应生成Fe(OH)3和溶液C的化学方程式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com