
【题目】一定量的Cu2S投入到足量浓硝酸中,收集到气体nmol,向反应后的溶液(存在Cu2+和SO42-)中加入足量NaOH,产生蓝色沉淀,过滤、洗涤、灼烧,得到CuO48.0g,若上述气体为NO和NO2混合物,且体积比为1:2。则n为( )
A.3.28B.1.80C.0.80D.1.63
【答案】B
【解析】
结合n=![]() 计算n(CuO),根据Cu元素守恒计算n(Cu2S),再根据电子转移数目守恒计算n(NO)、n(NO2),进而计算气体总物质的量,实际气体介于二者之间。
计算n(CuO),根据Cu元素守恒计算n(Cu2S),再根据电子转移数目守恒计算n(NO)、n(NO2),进而计算气体总物质的量,实际气体介于二者之间。
得到CuO48.0g,其物质的量为![]() =0.6mol,n(Cu2S)=
=0.6mol,n(Cu2S)=![]() n(CuO)=
n(CuO)=![]() ×0.6mol=0.3mol,Cu2S中S的化合价由-2价升高为+6价,且Cu元素的化合价由+1价升高为+2价,则转移电子物质的量0.3×(8+1×2)=3mol,上述气体为NO和NO2混合物,且体积比为1:2,设NO为xmol、NO2为2xmol,由电子守恒可知3x+2x=3,解得x=0.6,可知n=0.6+2×0.6=1.80。
×0.6mol=0.3mol,Cu2S中S的化合价由-2价升高为+6价,且Cu元素的化合价由+1价升高为+2价,则转移电子物质的量0.3×(8+1×2)=3mol,上述气体为NO和NO2混合物,且体积比为1:2,设NO为xmol、NO2为2xmol,由电子守恒可知3x+2x=3,解得x=0.6,可知n=0.6+2×0.6=1.80。
答案选B。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol SiO2中含有Si-O键为4NA
B.1 mol氢氧化铁胶粒所含氢氧化铁的分子数为NA
C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D.足量的Fe和1mol Cl2完全反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
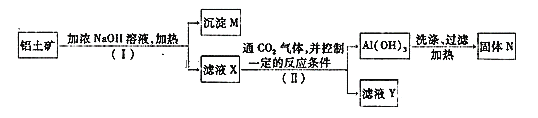
(1)I和Ⅱ步骤中分离溶液和沉淀的操作是:_____________。
(2)沉淀M中除含有泥沙外,一定还含有_________(填化学式),生成固体N反应的化学方程式为_________。
(3)滤液X中,含铝元素的溶质的化学式为___________,它属于__________(填“酸”、“碱”或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入___________(填“氨水”或“NaOH溶液”)来制取Al(OH)3,该反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
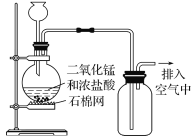
【题目】Cl2是中学化学重要气体之一,实验室常用二氧化锰与浓盐酸反应制取Cl2。请回答下列问题:
Ⅰ实验室用二氧化锰制取Cl2的化学方程式为______________________________,如图所示制取氯气装置中至少存在_____________明显错误。
Ⅱ实验室也可用高锰酸钾与浓盐酸反应制取Cl2,并收集和检验Cl2的性质。
已知:①KMnO4在不加热的条件下可与浓盐酸发生反应制取Cl2。
②无水CaCl2可吸收水蒸气。
(1)将反应原理补充完整:2KMnO4+16HCl(浓)=________+5Cl2↑+8H2O。
(2)选择实验装置,完成相应的实验:
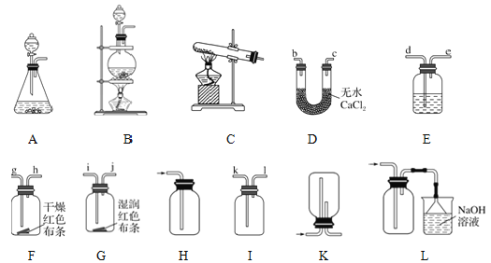
①若制取、收集干燥纯净的Cl2,按装置连接顺序可以选择其中的______(填序号)进行实验。
②若按A-E-D-F-G-L顺序连接装置进行实验,可得出的实验结论是___________。
③在上述实验①和②中,制取氯气前必须进行的一项操作是______,装置E中的试剂是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
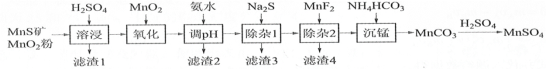
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列正确的叙述有()
A.CO2、NO2均为酸性氧化物,CaO、Na2O2均为碱性氧化物
B.Fe2O3不可与水反应得到Fe(OH)3,但能通过化合反应和复分解反应来制取Fe(OH)3
C.灼热的炭与CO2反应、![]() 与
与![]() 的反应均可设计成原电池
的反应均可设计成原电池
D.电解、电泳、电离、电镀、电化学腐蚀过程均需要通电才能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.8.7 g MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气的分子数为0.1NA
B.常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应为0.1NA
C.将含3NA个离子的Na2O2固体溶于水配成1 L溶液,所得溶液中Na+的浓度为2 mol·L-1
D.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以孔雀石[主要成分是CuCO3·Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2]为原料制备CuSO4·5H2O步骤如下:
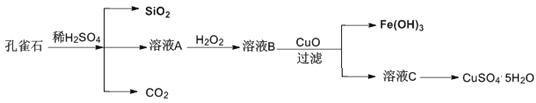
请回答下列问题:
(1)溶液A的金属离子有Fe3+和______________。
(2)溶液A中加入H2O2的目的是______________,发生的离子方程式为_____________________。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、______________、过滤等操作。
(4)溶液B与CuO反应生成Fe(OH)3和溶液C的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水反应生成一种氯化 物和两种氮化物,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

①仪器M的名称为_____.
②制备NO发生装置可以选用____(填写字母代号),请写出发生反应的离子方程式: ________.
③欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a->______(按气流方向,用小写字母表示)。
(2)乙组同学利用甲组制得的NO和Cl2制备NOC1,装置如下图所示。操作为:检验装置气密性并装入药品,打开K2,然后再打开K3通入一段时间气体Cl2,然后进行其他操作,当Z有一定量液体生成时, 停止实验。
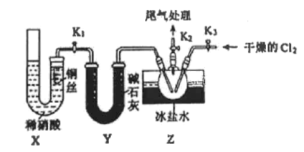
①实验室也可用X装置制备NO,相对甲组同学的气体发生装置,X装置的优点为______.
②若无装置Y,则Z中NOC1可能发生反应的化学方程式为____.
(3)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用 cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是________;亚硝酰氯(NOC1)的质量分数为________(用代数式表示)。
[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)= 1.56×10-10, Ksp(Ag2CrO4)=l×l012]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com