
����Ŀ��COCl2(����)��һ����Ҫ���л��м��壬��ũҩ��ҽҩ���������ϡ��۰��������Լ������϶���������;�������£�����һ����ɫ���壬�о綾���е�Ϊ8.2�棬����ˮ�����ڷ���������CCl4���л��ܼ�����ˮѸ��ˮ�������Ȼ��⡣ʵ���ҿ������Ȼ�̼��Ũ��������ȡ����,��ʵ��װ����ͼ��ʾ���ش��������⣺
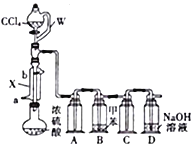
(1)����X��������________��ˮ��________(�a����b��)�ڽ��롣
(2)��Һ©�����β����뵼�ܲ�����W�����ӵ�Ŀ����____________________________��
(3)װ��A��C��������________��װ��D��������_____________________��Ϊȷ��ʵ�鰲ȫ,��ʵ��Ӧ��________(��ʵ����ʩ����)�н��С�
(4)�轫Բ����ƿ��Ũ���������120~130�棬Ϊ�˾������ȣ����˵ļ��ȷ�ʽ��________��Ȼ�������μ�CCl4�����ɲ�����������֪�μ�CCl4������ת��ΪS2O3Cl2����Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ________________________��
(5)�����ĵ���ʽΪ________��ҽ���ϳ��õ����������ȼ���ɱ�������������Ϊ����,Ϊ��ֹ�����¹ʣ�ʹ�����ȼ���ǰ����������Ƿ����������˵ļ����Լ�Ϊ________��
���𰸡� (ֱ��)������ a ʹ��Һ©������ѹǿ���,����Һ��˳������ ����ȫƿ ����HCl��������COCl2 ͨ��� ��ԡ(��ɳԡ)���� 3CCl4+2H2SO4(Ũ) ![]() 3COCl2��+4HCl��+S2O3Cl2
3COCl2��+4HCl��+S2O3Cl2 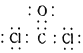 AgNO3��Һ��ϡ����
AgNO3��Һ��ϡ����
��������(1)����X��������(ֱ��)�����ܣ�������ˮ���������½��ϳ�������Ǵ�a�ڽ�����(2)��Һ©�����β����뵼�ܲ�����W�����ӵ�Ŀ����ʹ��Һ©������ѹǿ���,����Һ��˳�����£�(3)װ��A��C������������ȫƿ����ֹװ�ù�����װ��B��Ѹ���ܽ���ɵ�ѹǿ���ٱ仯��������װ��D�������ǣ�����HCl��������COCl2��ֱֹ���ŷ���ɿ�����Ⱦ��Ϊȷ��ʵ�鰲ȫ,��ʵ��Ӧ��ͨ����н��У�(4) �轫Բ����ƿ��Ũ���������120~130�棬����100�治����ˮԡ���ȣ�Ϊ�˾������ȣ����˵ļ��ȷ�ʽ����ԡ���Ȼ�ɳԡ���ȣ� CCl4�����ᷴӦ����S2O3Cl2���������Ȼ��⣬��Ӧ�Ļ�ѧ����ʽΪ3CCl4+2H2SO4(Ũ) ![]() 3COCl2��+4HCl��+S2O3Cl2��(5)�����ĵ���ʽΪ
3COCl2��+4HCl��+S2O3Cl2��(5)�����ĵ���ʽΪ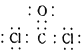 �����ȼ��鲻������������Ӧ��������ˮѸ��ˮ�������Ȼ��⣬����������Ӧ����������������Ȼ�����ɫ��������ʹ�����ȼ���ǰ����������Ƿ����������˵ļ����Լ�ΪAgNO3��Һ��ϡ���ᡣ
�����ȼ��鲻������������Ӧ��������ˮѸ��ˮ�������Ȼ��⣬����������Ӧ����������������Ȼ�����ɫ��������ʹ�����ȼ���ǰ����������Ƿ����������˵ļ����Լ�ΪAgNO3��Һ��ϡ���ᡣ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪a��b��c��d��e��f�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵ�ԭ������������������a��cԭ�ӵ�L����2��δ�ɶԵ��ӣ�d��eͬ����,d�Ķ�����������c�������Ӿ�����ͬ�ĵ��Ӳ�ṹ��f3+����M��3d�������Ϊ�����״̬�������������Ϣ���ش���������(����ʱ��������Ӧ��Ԫ�ط��ű�ʾ)��
��1������f3+���ӵļ۲�����Ų�ͼ__________��bH3������bԭ�ӵļ۲���ӶԹ���Ϊ__________��
��2��д��һ����ab-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ_________��ab-��aԭ�ӵ��ӻ���ʽΪ_______��
��3��f��m(������Ϊ25) ��Ԫ�صIJ��ֵ��������������±���
Ԫ�� | m | f | |
����(kJ��mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
�Ƚ���Ԫ�ص�I2��I3��֪����̬m2+��ʧȥһ�����ӱ���̬f2+��ʧȥһ�������ѣ�ԭ����____________��
��4����֪e��̼�������ȷֽ��¶ȱ�d�ĸߣ���ԭ����___________________��
��5����֪CaF2���峣�������ۼ����侧���ṹ��ͼ��ʾ��
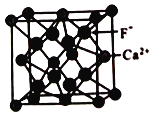
�谢���ӵ�������ֵΪNA ��Fԭ�Ӻ�Caԭ��֮��ľ���Ϊapm���ھ�����Խ��ߵ�1/4��3/4����ֱ��и�F-����Ca2+����λ����_______��������ܶ�Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij����FeCl2��FeCl3��CuCl2�Ĺ�ҵ��Һ�л���ͭ���Ʊ��Ȼ��������������ͼ:
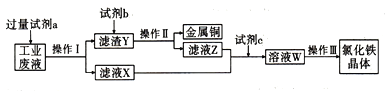
��֪: FeCl3�ڼ����������ˮ��Ӧ����Fe(OH)3��
�ش���������:
(1)�Լ�a��________��������ԭ����__________������I�õ��IJ���������__________��
(2)��ҺX��Z�ж���ͬһ�����ʣ������ʵ����֤�����ʵ�����:___________
(3)���ˮ����εμ�1mol/L FeCl3��Һ����Һ������ĺ��ɫ���÷�ɢϵ������ֱ���ķ�Χ��____nm,������Һ��Fe3+���ڵ��Լ���_________(����������)��֤��Fe���ڵ�������__________�����ӹ�ҵ��Ҫ��30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ������ӡˢ��·�壬��д��FeCl3�ܱ���ͭ��Ӧ�����ӷ���ʽ:______��
(4)��Ҫ��֤��Һ�в���Fe3+��ֻ����Fe2+����ȷ��ʵ�����������������___________��
(5)��������������Ҫ�ɷ�ΪFe2O3��FeO��SiO2�ȣ����ⶨ������������FeԪ�ص�������������ȡag��Ʒ����֡����ܡ�����ˮ�ܡ�����ˣ����˱��м���������H2O2����ַ�Ӧ�����NaOH��Һ�����ټ������������������ˡ�ϴ�ӡ�������������أ���ȴ��Ƶò�������bg���������Ʒ��FeԪ�ص���������Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���й��������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ�������
A. pH=12��Ba(OH)2��Һ��pH=12��Na2CO3��Һ�У�ˮ�����c(OH��)���
B. �����½������ơ���������Һ��Ϻ���Һ�����ԣ����Ϻ���Һ�У�c(Na+)>c(Cl����>c(CH3COOH)
C. ���������ʵ���Ũ����ȵĢ�NH4HCO3����NH4HSO4����NH4Fe(SO4)2����NH3H2O������Һ��NH4����Ũ�ȣ���>��>��>��
D. ����������ʵ���Ũ�ȵ�NaClO(aq)��NaCl(aq)������������Nǰ>N��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������������Һ��
�� | �� | �� | �� |
0.1mol/L ���� | pH = 3���� | 0.1mol/L ��ˮ | pH = 11��ˮ |
����˵����ȷ����
A. ��ˮ�������c(H+):�٣���
B. ��ϡ�͵�ԭ����100����pH������ͬ
C. ��������ϣ�����ҺpH = 7����V(����)��V(��ˮ)
D. ��������ϣ�����Һ�Լ��ԣ���������Һ������Ũ�ȿ���Ϊ��c(NH4+)��c(OH-)��c(Cl-)��c(H+)
���𰸡�D
�����������������A.��ͬŨ�ȵİ�ˮ�����ᣬ��ˮʵ���ϻ���ٽ�ˮ�ĵ��룬������ˮ���������c(H+):��������B.�������ǿ��Ļ���ϡ��100������pHһ��Ϊ11�����ǹؼ���ˮ���������ϡ�͵�ʲô�̶ȣ�������δ����İ�ˮ���ڣ�����pHһ����11ҪС��C.��������ϵõ������Ȼ�泥��Ȼ����ǿ�������Σ������ԣ���������Ҫ��pHΪ7����ˮ������һ��Ҫ�������������ſ��ԡ�D.������Һ�Լ��ԣ��������������ӵ�Ũ��һ��Ҫ�������ӵ�Ũ�ȴ���笠����ӵ�Ũ��Ҫ�������ӵ�Ũ�ȴ�
���㣺������������ʵĵ���ƽ�⡢����ˮ�⡢����Ũ�ȵĴ�С�Ƚϵ����֪ʶ��
�����͡���ѡ��
��������
18
����Ŀ��25��ʱ��������������ˮ��Һ�еĵ�����ƽ�ⳣ�����������ѡ����ȷ���ǣ�������
�����ᣨHCN�� | ̼�ᣨH2C03�� | ����ᣨHF�� |
K=4.9��10��10 | K1=4.4��10��7 K2=4.7��10��11 | K=6.61��10��4 |
A. �軯����Һ��ͨ������CO2��2CN��+H2O+CO2�T2HCN+CO32��
B. NaCN��HCN�Ļ����Һ��һ���У�c��Na+����c��CN������c��HCN����c��H+����c��OH-��
C. 25��ʱCN-��ˮ��ƽ�ⳣ��ԼΪ1.6��10-5
D. NaCN��HCN�Ļ����Һ�У�2c(Na+)=c(CN����+c(HCN)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к���HCO3����Na+��Ba2+��NO3��4�����ӣ��������м�������Na2O2�������Һ������Ũ�Ȼ������ֲ�����ǣ� ��
A.HCO3��
B.Na+
C.Ba2+
D.NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����pH��ֽ��������Һ��pHʱ�������Ƚ�pH��ֽ������ˮ��ʪ������������
A. ƫ�� B. ƫС C. ���� D. ���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п����γ�AB2�����ӻ����������Ԫ�أ����ǵ�ԭ������������( )
A.6��8B.12��7C.20��16D.12��9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˵����Ϊ1~18��Ԫ���У�����������ȷ����
A.�����ֻ��1�����ӵ�Ԫ��һ���ǽ���Ԫ��
B.�����ֻ��2�����ӵ�Ԫ��һ���ǽ���Ԫ��
C.ԭ�Ӻ�������������ȵ�Ԫ��һ���ǽ���Ԫ��
D.ԭ���������������ܳ���8��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com