
【题目】已知a、b、c、d、e、f都是周期表中前四周期的元素,它们的原子序数依次增大。其中a、c原子的L层有2个未成对电子,d与e同主族,d的二价阳离子与c的阴离子具有相同的电子层结构,f3+离子M层3d轨道电子为半充满状态。请根据以上信息,回答下列问题(答题时,用所对应的元素符号表示):
(1)画出f3+离子的价层电子排布图__________,bH3分子中b原子的价层电子对构型为__________。
(2)写出一种与ab-互为等电子体的分子的化学式_________,ab-中a原子的杂化方式为_______。
(3)f和m(质子数为25) 两元素的部分电离能数据列于下表:
元素 | m | f | |
电能(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态m2+再失去一个电子比气态f2+再失去一个电子难,原因是____________。
(4)已知e的碳酸正盐热分解温度比d的高,其原因是___________________。
(5)已知CaF2晶体常用于助熔剂,其晶胞结构如图所示。
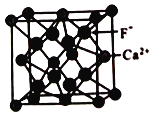
设阿伏加德罗常数的值为NA ,F原子和Ca原子之间的距离为apm,在晶胞体对角线的1/4、3/4两点分别有个F-,则Ca2+的配位数是_______,晶体的密度为_______。
【答案】 ![]() 四面体形 CO成N2 sp杂化 Mn2+的3d轨道电子排布为半充满状态较稳定 Mg2+半经比Ca2+小,MgO的晶格能比CaO大,MgCO3比CaCO3更易分解,因此CaCO3热分解温度较高 8
四面体形 CO成N2 sp杂化 Mn2+的3d轨道电子排布为半充满状态较稳定 Mg2+半经比Ca2+小,MgO的晶格能比CaO大,MgCO3比CaCO3更易分解,因此CaCO3热分解温度较高 8 ![]() ×1030g/cm3
×1030g/cm3
【解析】试题分析:a、c原子的L层有2个未成对电子,a是C元素、c是O元素、b是N元素;d的二价阳离子与![]() 具有相同的电子层结构,d是Mg元素; f3+离子M层3d轨道电子为半充满状态,f是Fe元素;d与e同主族,e是Ca元素;
具有相同的电子层结构,d是Mg元素; f3+离子M层3d轨道电子为半充满状态,f是Fe元素;d与e同主族,e是Ca元素;
解析:根据以上分析,(1)Fe3+3d轨道上的电子为价电子,Fe3+价层电子排布图是![]() ,NH3分子中N原子的价电子对数为
,NH3分子中N原子的价电子对数为![]() ,价层电子对构型为四面体形。(2)等电子体是原子数相同,价电子数相同的分子或离子,与CN-互为等电子体的分子的化学式CO或N2,CN-中C和N之间是叁键,C的σ键有2个,无孤电子对,价层电子对数为2,属于sp杂化。(3)f是Fe、m(质子数为25)是Mn,Mn2+的3d轨道电子排布为半充满状态较稳定,Fe2+的3d轨道有6个电子,所以气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难;(4)Mg2+半经比Ca2+小,MgO的晶格能比CaO大,MgCO3比CaCO3更易分解,因此CaCO3热分解温度较高; (5)在晶胞体对角线的1/4、3/4两点分别有个F-,则Ca2+的配位数是8;晶胞体对角线的1/4、3/4两点分别有个F-,所以1个晶胞含有8个F-;根据均摊原则,1个晶胞含有Ca2+=
,价层电子对构型为四面体形。(2)等电子体是原子数相同,价电子数相同的分子或离子,与CN-互为等电子体的分子的化学式CO或N2,CN-中C和N之间是叁键,C的σ键有2个,无孤电子对,价层电子对数为2,属于sp杂化。(3)f是Fe、m(质子数为25)是Mn,Mn2+的3d轨道电子排布为半充满状态较稳定,Fe2+的3d轨道有6个电子,所以气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难;(4)Mg2+半经比Ca2+小,MgO的晶格能比CaO大,MgCO3比CaCO3更易分解,因此CaCO3热分解温度较高; (5)在晶胞体对角线的1/4、3/4两点分别有个F-,则Ca2+的配位数是8;晶胞体对角线的1/4、3/4两点分别有个F-,所以1个晶胞含有8个F-;根据均摊原则,1个晶胞含有Ca2+=![]() ,所以晶胞的摩尔质量是312g/mol;F原子和Ca原子之间的距离为apm,则晶胞的边长是
,所以晶胞的摩尔质量是312g/mol;F原子和Ca原子之间的距离为apm,则晶胞的边长是![]() ,所以晶体的密度是
,所以晶体的密度是![]()
![]() ×1030g/cm3 。
×1030g/cm3 。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)
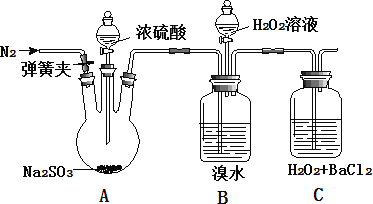
实验操作 | 实验现象 |
i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A 中发生反应的化学方程式是_____。
(2)B 中红棕色褪色的离子方程式是_____。
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_____。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是_____。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是_____。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_____。
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用煤干馏的产物W为基本原料合成一系列化工产品,其流程如下(部分产物和条件省略):
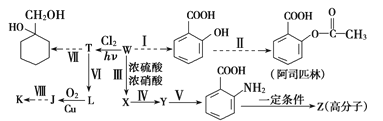
己知部分信息如下:
①1mol芳香烃W含50mol电子;
②![]()
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
④K的分子式为C7H6O2,其核磁共振氢谱上有4个峰。
请回答下列问题:
(1)Y的名称为_______,反应Ⅳ的反应类型为__________。
(2)反应Ⅲ的化学方程式为___________
(3)J的分子式为_____________
(4)Z的结构简式为__________
(5)K的同分异构体M既能发生水解反应,又能发生银镜反应,M在氢氧化钠溶液中发生水解反应的化学方程式为_________
(6)L的同分异构体中,能和氯化铁溶液发生显色反应的有_______种。
(7)补充步骤Ⅶ流程:(仿照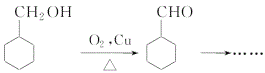 )_______
)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿的主要化学成分为CeFCO3,它是提取铈族稀土元素的重要矿物原料,二氧化铈(CeO2) 是一种重要的稀土氧化物。以氟碳铈矿为原料制备CeO2的一种工艺流程如下:
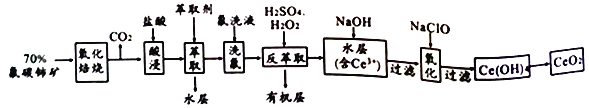
已知:①Ce 4+既能与F 结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+ 能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1) “氧化焙烧”的目的是______________。
(2)“酸浸”中会产生大量黄绿色气体、请写出CeO2与盐酸反应的离子方程式___________________;为避免产生上述污染,请提出一种解决方案________________________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce+(H2a-4A2a)+4H+。实验室中萃取时用到的主要玻璃仪器为______________;若缺少 “洗氟”,则所得产品的质量将_________(填“偏大”、“偏小”或 “不变”)。
Ce+(H2a-4A2a)+4H+。实验室中萃取时用到的主要玻璃仪器为______________;若缺少 “洗氟”,则所得产品的质量将_________(填“偏大”、“偏小”或 “不变”)。
(4) “反萃取”中,加稀硫酸和H2O2的作用__________________(用离子方程式表示)。
(5)取上述流程中得到的CeO2产品0.500g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不参加反应)消25.00mL标准溶液,该产品中CeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属元素原子结构上的相同点是( )
A. 原子核外电子层数相同B. 原子核外电子数相同
C. 原子核外最外层电子数相同D. 原子核内核电荷数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是
2NO2(g)在温度为T1、T2(T2>T1)时,平衡体系中NO2的体积分数随压强变化如图所示。下列说法正确的是

A. 由图可知B点的平衡常数大于C点的平衡常数
B. A、C两点气体的颜色:A深,C浅
C. A、C两点气体的平均相对分子质量:A<C
D. 保持容器体积不变,再充入N2O2气体,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。”这里的“强水”是指( )
A.氨水B.卤水C.醋D.硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(光气)是一种重要的有机中间体,在农药、医药、工程塑料、聚氨酯材料以及军事上都有许多用途。常温下,它是一种无色气体,有剧毒,沸点为8.2℃,微溶于水,溶于芳烃、苯、CCl4等有机溶剂,遇水迅速水解生成氯化氢。实验室可用四氯化碳和浓硫酸来制取光气,其实验装置如图所示。回答下列问题:
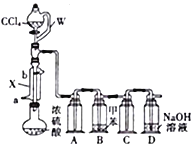
(1)仪器X的名称是________,水从________(填“a”或“b”)口进入。
(2)分液漏斗球形部分与导管部分用W管连接的目的是____________________________。
(3)装置A和C的作用是________;装置D的作用是_____________________;为确保实验安全,该实验应在________(填实验设施名称)中进行。
(4)需将圆底烧瓶中浓硫酸加热至120~130℃,为了均匀受热,适宜的加热方式是________;然后慢慢滴加CCl4,即可产生光气。已知滴加CCl4后硫酸转化为S2O3Cl2,则圆底烧瓶中发生反应的化学方程式为________________________。
(5)光气的电子式为________;医疗上常用的麻醉剂三氯甲烷可被空气缓慢氧化为光气,为防止发生事故,使用三氯甲烷前必须检验其是否被氧化,适宜的检验试剂为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com