
【题目】某同学拟用煤干馏的产物W为基本原料合成一系列化工产品,其流程如下(部分产物和条件省略):
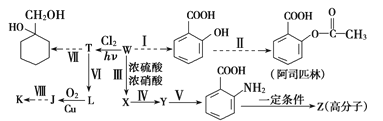
己知部分信息如下:
①1mol芳香烃W含50mol电子;
②![]()
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
④K的分子式为C7H6O2,其核磁共振氢谱上有4个峰。
请回答下列问题:
(1)Y的名称为_______,反应Ⅳ的反应类型为__________。
(2)反应Ⅲ的化学方程式为___________
(3)J的分子式为_____________
(4)Z的结构简式为__________
(5)K的同分异构体M既能发生水解反应,又能发生银镜反应,M在氢氧化钠溶液中发生水解反应的化学方程式为_________
(6)L的同分异构体中,能和氯化铁溶液发生显色反应的有_______种。
(7)补充步骤Ⅶ流程:(仿照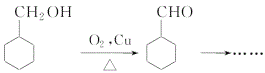 )_______
)_______
【答案】 邻硝基苯甲酸 氧化反应 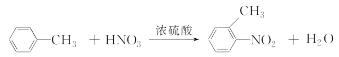
![]()

![]() 3
3 
【解析】W为煤干馏的产物,1mol芳香烃W含50mol电子,则W的分子式为C7H8,结构简式为![]() 。
。
(1)根据流程图,甲苯发生硝化反应生成X,X为 ,由于苯胺易被氧化,因此X首先氧化生成邻硝基苯甲酸,在还原生成邻氨基苯甲酸,因此Y为邻硝基苯甲酸,反应Ⅳ为氧化反应,故答案为:邻硝基苯甲酸;氧化反应;
,由于苯胺易被氧化,因此X首先氧化生成邻硝基苯甲酸,在还原生成邻氨基苯甲酸,因此Y为邻硝基苯甲酸,反应Ⅳ为氧化反应,故答案为:邻硝基苯甲酸;氧化反应;
(2)根据流程图可知,反应Ⅲ为甲苯发生的硝化反应,反应的化学方程式为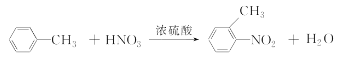 ,故答案为:
,故答案为: ;
;
(3)根据流程图,甲苯与氯气在光照条件下发生侧链的取代反应生成T,结合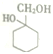 可知,T为
可知,T为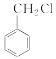 ,K的分子式为C7H6O2,其核磁共振氢谱上有4个峰,则K为苯甲酸,则J为苯甲醛,L为苯甲醇,J的分子式为C7H6O,故答案为:C7H6O;
,K的分子式为C7H6O2,其核磁共振氢谱上有4个峰,则K为苯甲酸,则J为苯甲醛,L为苯甲醇,J的分子式为C7H6O,故答案为:C7H6O;
(4)氨基酸分子间能够通过缩聚反应生成高分子化合物,因此Z的结构简式为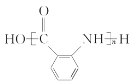 ,故答案为:
,故答案为: ;
;
(5)K为苯甲酸,K的同分异构体M既能发生水解反应,又能发生银镜反应,则M为![]() ,M在氢氧化钠溶液中发生水解反应的化学方程式为
,M在氢氧化钠溶液中发生水解反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(6)L为苯甲醇,L的同分异构体中,能和氯化铁溶液发生显色反应,说明含有酚羟基,说明苯环上含有羟基和甲基,有3种结构,故答案为:3;
(7)根据上述分析,步骤Ⅶ是 →
→ ,可以首先将苯环还原生成
,可以首先将苯环还原生成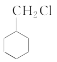 ,再将氯原子消去后与氯气加成,生成
,再将氯原子消去后与氯气加成,生成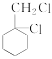 ,最后水解即可,流程图为
,最后水解即可,流程图为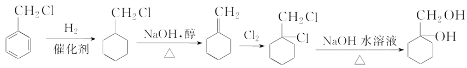 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应,xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.40 mol·L-1,保持温度不变,将容器的容积缩小为原来的一半,再达平衡时,测得A的浓度升高为0.70 mol·L-1。下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为0.40 mol·L-1,保持温度不变,将容器的容积缩小为原来的一半,再达平衡时,测得A的浓度升高为0.70 mol·L-1。下列有关判断正确的是( )
A. x+y>z B. 平衡向逆反应方向移动
C. B的转化率减小 D. C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,一段时间后下列叙述正确的是( )
A.Na2CO3溶液的碱性增强
B.阳极反应:CO32--2e-+H2O = CO2↑+2OH-
C.溶液中CO32-+H2O ![]() HCO3-+OH-平衡不移动
HCO3-+OH-平衡不移动
D.向溶液中加入一定量HCOOH的能复原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列相关内容:
(1)在常温下,将体积为 VaL、pH 为 a 的稀硫酸和体积为 VbL、pH为 b 的烧碱溶液混合,若所得混合液为中性。如果 a+b=15,则 Va:Vb=_______。某温度时,水的离子积常数 Kw=1×10-13.在此温度下,将 pH=a 的硫酸溶液 VaL与 pH=b的 NaOH 溶液 VbL 混合,若所得混合液为中性,如果 a+b=12,则 Va:Vb=_______。
(2)中和相同体积,相同 pH 的 Ba(OH)2、NH3·H2O、NaOH 三种稀溶液所用相同浓度的盐酸的体积分别为 V1、V2、V3,则三种关系为______________(用“V1、V2、V3”和“>、<、=”表示)。
(3)常温下将 0.2mol/LHCl 溶液与 0.2mol/LMOH 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 pH=6,试回答以下问题:
①0.2mol/LHCl 溶液中由水电离出的 c(H+)______0.2mol/LMOH 溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=_______mol/L。
③已知 Ksp(CaCO3)=2.8×10-9mol2·L-2. 现将 CaCl2 溶液与 0.02 mol·L-1Na2CO3 溶液等体积混合,生成 CaCO3 沉淀时,所需 CaCl2 溶液的最小物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体体积的大小与许多因素有关.当温度和压强一定时,气体体积主要取决于( )
A.气体的种类
B.气体的物质的量
C.气体分子本身的大小
D.气体分子之间的平均距离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒半径由小到大的排列顺序正确的是( )
A.Na<Si<PB.O2->Mg2+>Al3+
C.Ca>Ba>Ca2+D.Cl->F>F-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A. 断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl-
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c、d、e、f都是周期表中前四周期的元素,它们的原子序数依次增大。其中a、c原子的L层有2个未成对电子,d与e同主族,d的二价阳离子与c的阴离子具有相同的电子层结构,f3+离子M层3d轨道电子为半充满状态。请根据以上信息,回答下列问题(答题时,用所对应的元素符号表示):
(1)画出f3+离子的价层电子排布图__________,bH3分子中b原子的价层电子对构型为__________。
(2)写出一种与ab-互为等电子体的分子的化学式_________,ab-中a原子的杂化方式为_______。
(3)f和m(质子数为25) 两元素的部分电离能数据列于下表:
元素 | m | f | |
电能(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态m2+再失去一个电子比气态f2+再失去一个电子难,原因是____________。
(4)已知e的碳酸正盐热分解温度比d的高,其原因是___________________。
(5)已知CaF2晶体常用于助熔剂,其晶胞结构如图所示。
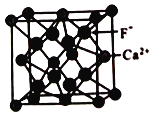
设阿伏加德罗常数的值为NA ,F原子和Ca原子之间的距离为apm,在晶胞体对角线的1/4、3/4两点分别有个F-,则Ca2+的配位数是_______,晶体的密度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如图:
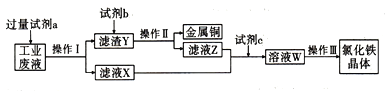
已知: FeCl3在加热情况下与水反应生成Fe(OH)3。
回答下列问题:
(1)试剂a是________,过量的原因是__________。操作I用到的玻璃仪器是__________。
(2)滤液X、Z中都有同一种溶质,请设计实验验证该溶质的离子:___________
(3)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是____nm,检验溶液中Fe3+存在的试剂是_________(填物质名称),证明Fe存在的现象是__________。电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶被与铜反应的离子方程式:______。
(4)若要验证溶液中不含Fe3+而只含有Fe2+,正确的实验操作方法及现象是___________。
(5)硫铁矿烧渣的主要成分为Fe2O3、FeO、SiO2等,欲测定硫铁矿烧清中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤被中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。计算该样品中Fe元素的质量分数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com