
����Ŀ����̼������Ҫ��ѧ�ɷ�ΪCeFCO3��������ȡ����ϡ��Ԫ�ص���Ҫ����ԭ�ϣ���������(CeO2) ��һ����Ҫ��ϡ��������Է�̼���Ϊԭ���Ʊ�CeO2��һ�ֹ�������������
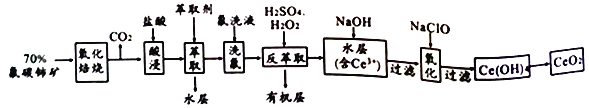
��֪����Ce 4+������F ��ϳ�[CeFx](4-x)+,Ҳ����SO42-��ϳ�[CeSO4]2+��
����������ϵ��Ce4+ �ܱ���ȡ��[(HA)2]��ȡ����Ce3+���ܡ�
�ش��������⣺
��1�� ��������������Ŀ����______________��
��2����������л������������ɫ���塢��д��CeO2�����ᷴӦ�����ӷ���ʽ___________________��Ϊ�������������Ⱦ�������һ�ֽ������________________________��
��3������ȡ��ʱ���ڷ�Ӧ��Ce4++n(HA)2![]() Ce+(H2a-4A2a)+4H+��ʵ��������ȡʱ�õ�����Ҫ��������Ϊ______________����ȱ�� ��ϴ�����������ò�Ʒ��������_________(����ƫ��������ƫС���� ��������)��
Ce+(H2a-4A2a)+4H+��ʵ��������ȡʱ�õ�����Ҫ��������Ϊ______________����ȱ�� ��ϴ�����������ò�Ʒ��������_________(����ƫ��������ƫС���� ��������)��
��4�� ������ȡ���У���ϡ�����H2O2������__________________(�����ӷ���ʽ��ʾ)��
��5��ȡ���������еõ���CeO2��Ʒ0.500g���������ܽ����0.1000mol��L-1FeSO4����Һ�ζ����յ�ʱ(�汻��ԭΪCe3+���������ʾ����μӷ�Ӧ)��25.00mL����Һ���ò�Ʒ��CeO2����������Ϊ________��
���𰸡� ��+3����������+4��(��CeFCO3������CeO2) 2CeO2+8H++2Cl-=2Ce3++Cl2��+4H2O ����H2SO4��� ��Һ©�� ƫС Ce4++H2O2=2Ce3++O2��+2H+ 86.0%��0.86
�������������������1�����������ա����Խ���+3����������+4������2��������������ᱻCeO2����Ϊ����ɫ������CeO2����ԭΪCe3+��Ϊ����������ԭ��Ӧ���������Ը�����������3������ȡ��ʱҪ��Һ������Ce4+����F-��ϳ�[CeFx](4-x)+��������4����������ϵ��Ce4+�ܱ���ȡ��[(HA)2]��ȡ����Ce3+������������ȡ���У���ϡ�����H2O2���Խ�Ce4+��ԭΪCe3+����5�����ݵ����غ�FeSO4��CeO2�Ĺ�ϵʽ��FeSO4![]() CeO2�����ù�ϵʽ������
CeO2�����ù�ϵʽ������
��������1�����������ա����Խ�CeFCO3��+3����������CeO2��+4��������2��������������ᱻCeO2����Ϊ����ɫ������CeO2����ԭΪCe3+�����ӷ���ʽ��2CeO2+8H++2Cl-=2Ce3++Cl2��+4H2O ��Ϊ����������ԭ��Ӧ���������Ը���H2SO4�������3������ȡ��ʱҪ��Һ���õ�����Ҫ���������Ƿ�Һ©����Ce4+����F-��ϳ�[CeFx](4-x)+����ȱ����ϴ�����������ò�Ʒ��������ƫС����4����������ϵ��Ce4+�ܱ���ȡ��[(HA)2]��ȡ����Ce3+������������ȡ���У���ϡ�����H2O2���Խ�Ce4+��ԭΪCe3+����Ӧ���ӷ���ʽ��Ce4++H2O2=2Ce3++O2��+2H+��
��5����CeO2��������xg
FeSO4 ![]() CeO2 ��
CeO2 ��
1mol 172g
0.025L![]() 0.1mol��L-1 xg
0.1mol��L-1 xg
![]()
X=0.43g���ò�Ʒ��CeO2����������Ϊ![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɴ��ϳ�ʹ������ȼ�ϵ�أ���缫�ܷ�ӦʽΪ��2H2+O2��2H2O�����������ҺΪKOH��Һ��������������ȷ���ǣ�
A. �˵���ܼ���dz��ɫ���� B. H2Ϊ������O2Ϊ����
C. ����ʱ���Һ��OH�������ʵ����������� D. �缫��Ӧ�У� H2ʧ���ӣ� O2�õ���
���𰸡�D
��������A���õ����������ȼ�գ����Բ��ܼ���dz��ɫ���棬A����B����ԭ����У�������ͨ��������������ͨ��������B����C����ط�ӦʽΪ��2H2+O2=2H2O�����ݷ���ʽ֪���������Һ�����������ӵ����ʵ������䣬C����D�������ϵ缫��ӦʽΪ��2H2+4OH--4e-��4H2O�������ϵ缫��ӦʽΪ��O2+2H2O+4e-��4OH-�����Ը���������ʧ���ӣ������������õ��ӣ�D��ȷ����ѡD��
�㾦�����⿼��ȼ�ϵ�أ���ȷ�������ϵ�ʧ�����ǽⱾ��ؼ����ѵ��ǵ缫��Ӧʽ����д���缫��Ӧʽ����дҪ��ϵ������Һ������ԣ���ʱ����Ҫ���ǽ���Ĥ�Լ��Dz������ڵĵ���ʵȡ�
�����͡���ѡ��
��������
21
����Ŀ�����淴ӦaA��g��+bB��s��cC��g��+dD��g���������������䣬C�����ʵ����������¶ȣ�T����ѹǿ��P����ϵ��ͼ��������ȷ���� ������ ��
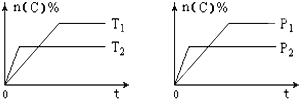
A. P1 > P2
B. �÷�Ӧ����H < 0
C. ��ѧ����ʽϵ��a��c+d
D. ʹ�ô�����C�����ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����д����������ݣ�
��1���ڳ����£������Ϊ VaL��pH Ϊ a ��ϡ��������Ϊ VbL��pHΪ b ���ռ���Һ��ϣ������û��ҺΪ���ԡ���� a+b=15���� Va��Vb=_______��ij�¶�ʱ��ˮ�����ӻ����� Kw=1��10-13���ڴ��¶��£��� pH=a ��������Һ VaL�� pH=b�� NaOH ��Һ VbL ��ϣ������û��ҺΪ���ԣ���� a+b=12���� Va��Vb=_______��
��2���к���ͬ�������ͬ pH �� Ba(OH)2��NH3��H2O��NaOH ����ϡ��Һ������ͬŨ�ȵ����������ֱ�Ϊ V1��V2��V3�������ֹ�ϵΪ______________(�á�V1��V2��V3���͡�>��<��=����ʾ)��
��3�������½� 0.2mol/LHCl ��Һ�� 0.2mol/LMOH ��Һ�������ϣ����Ի�Ϻ���Һ����ı仯������û����Һ�� pH=6���Իش��������⣺
��0.2mol/LHCl ��Һ����ˮ������� c��H+��______0.2mol/LMOH ��Һ����ˮ�������c��H+�����������������������=����
����������Һ��������ʽ�ľ�ȷ����������������֣���c��Cl-��-c��M+��=_______mol/L��
����֪ Ksp��CaCO3����2.8��10��9mol2��L��2�� �ֽ� CaCl2 ��Һ�� 0.02 mol��L��1Na2CO3 ��Һ�������ϣ����� CaCO3 ����ʱ������ CaCl2 ��Һ����С���ʵ���Ũ��Ϊ______mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������뾶��С���������˳����ȷ����(����)
A.Na��Si��PB.O2����Mg2����Al3��
C.Ca��Ba��Ca2��D.Cl����F��F��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС�������ͼ��ʾ����ʵ��װ�á�ʵ��ʱ���ֶϿ�K2���պ�K1�������������ݲ�����һ��ʱ��Ͽ�K1���պ�K2�����ֵ�����ָ��ƫת�������й�������ȷ����

A. �Ͽ�K2���պ�K1ʱ���ܷ�Ӧ�����ӷ���ʽΪ��2H+ + 2Cl-![]() Cl2��+H2��
Cl2��+H2��
B. �Ͽ�K2���պ�K1ʱ��ʯī�缫������Һ���
C. �Ͽ�K1���պ�K2ʱ��ͭ�缫�ϵĵ缫��ӦΪ�� Cl2+2e-��2Cl-
D. �Ͽ�K1���պ�K2ʱ��ʯī�缫������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���������������Ϊ���淴ӦA��g��+3B��g��![]() 2C��g���ﵽƽ���־����
2C��g���ﵽƽ���־����
��C������������C�������������
�ڵ�λʱ��������a mol A��ͬʱ����3a mol B
��A��B��C��Ũ�Ȳ��ٱ仯
��C�����ʵ������ٱ仯
�ݻ���������ѹǿ���ٱ仯
�������������ʵ������ٱ仯
�ߵ�λʱ������a molA��ͬʱ����3a mol B
��A��B��C�ķ�����֮��Ϊ1��3��2
A. �ݢ�B. �ߢ�C. �٢�D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪a��b��c��d��e��f�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵ�ԭ������������������a��cԭ�ӵ�L����2��δ�ɶԵ��ӣ�d��eͬ����,d�Ķ�����������c�������Ӿ�����ͬ�ĵ��Ӳ�ṹ��f3+����M��3d�������Ϊ�����״̬�������������Ϣ���ش���������(����ʱ��������Ӧ��Ԫ�ط��ű�ʾ)��
��1������f3+���ӵļ۲�����Ų�ͼ__________��bH3������bԭ�ӵļ۲���ӶԹ���Ϊ__________��
��2��д��һ����ab-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ_________��ab-��aԭ�ӵ��ӻ���ʽΪ_______��
��3��f��m(������Ϊ25) ��Ԫ�صIJ��ֵ��������������±���
Ԫ�� | m | f | |
����(kJ��mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
�Ƚ���Ԫ�ص�I2��I3��֪����̬m2+��ʧȥһ�����ӱ���̬f2+��ʧȥһ�������ѣ�ԭ����____________��
��4����֪e��̼�������ȷֽ��¶ȱ�d�ĸߣ���ԭ����___________________��
��5����֪CaF2���峣�������ۼ����侧���ṹ��ͼ��ʾ��
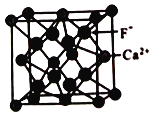
�谢���ӵ�������ֵΪNA ��Fԭ�Ӻ�Caԭ��֮��ľ���Ϊapm���ھ�����Խ��ߵ�1/4��3/4����ֱ��и�F-����Ca2+����λ����_______��������ܶ�Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��µ��ܱ������У���Ӧ2SO2(g)+O2(g)![]() 2SO3(g)�ﵽƽ�⡣��С�����ݻ����Է�Ӧ����Ӱ�����������ȷ����
2SO3(g)�ﵽƽ�⡣��С�����ݻ����Է�Ӧ����Ӱ�����������ȷ����
A. ʹSO3��Ũ������ B. ʹƽ��������Ӧ�����ƶ�
C. ʹƽ�ⳣ��K���� D. ʹ����Ӧ���ʴ����淴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���й��������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ�������
A. pH=12��Ba(OH)2��Һ��pH=12��Na2CO3��Һ�У�ˮ�����c(OH��)���
B. �����½������ơ���������Һ��Ϻ���Һ�����ԣ����Ϻ���Һ�У�c(Na+)>c(Cl����>c(CH3COOH)
C. ���������ʵ���Ũ����ȵĢ�NH4HCO3����NH4HSO4����NH4Fe(SO4)2����NH3H2O������Һ��NH4����Ũ�ȣ���>��>��>��
D. ����������ʵ���Ũ�ȵ�NaClO(aq)��NaCl(aq)������������Nǰ>N��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com