
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡标志的是
2C(g)达到平衡标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a molA,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2
A. ⑤⑥B. ⑦④C. ①③D. ②⑧
【答案】D
【解析】
可逆反应A(g)+3B(g)2C(g),反应物气体的计量数大于生成物气体的计量数,当达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量不变,可以此判断是否得到平衡状态。
①C的生成速率与C的消耗速率相等时,该反应达到平衡状态,故正确;②无论反应是否达到平衡状态,单位时间内生成a mol A同时生成3a molB,所以不能说明该反应达到平衡状态,故错误;③A、B、C的浓度不再变化,可说明达到平衡状态,故正确;④C的物质的量不再变化,可说明达到平衡状态,故正确;⑤由于反应前后气体的体积不等,恒容容器中,混合气体的总压强不再变化,可说明达到平衡状态,故正确;⑥混合气体的总物质的量不再变化,可说明达到平衡状态,故正确;⑦单位时间消耗amolA,同时生成3amolB,说明正逆反应速率相等,则达到平衡状态,故正确;⑧A、B、C的分子数之比为1:3:2,不能用以判断是否达到平衡状态,与起始配料比以及反应的转化程度有关,故错误;答案选D。


科目:高中化学 来源: 题型:
【题目】垃圾渗滤液会污染地下水,为此科研人员设计了一种处理垃圾渗滤液并利用其进行发电的装置,该装置的工作原理如图所示。下列说法正确的是( )

A. 电池工作时,盐桥中的K+和Cl-不发生移动
B. 电池工作时,电子由Y极经导线流向X极
C. 电池工作时,X极和Y极周围溶液的pH均降低
D. 电池工作时,电池总反应为3NO3-+5NH3+3H+=4N2+9H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,产生氢气速度最快的是( )
A.常温下铝与6mol/L的硝酸B.常温下镁与3mol/L的醋酸
C.常温下铁与3mol/L的盐酸D.常温下镁与3mol/L的硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置模拟工业NaClO3与Na2SO3在浓H2SO4存在下制备ClO2,并以ClO2为原料制备NaClO2(已知:高于60℃时,NaClO2分解生成NaClO3和NaCl)。
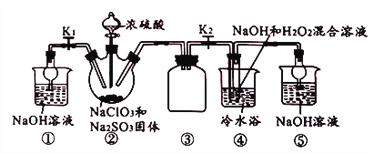
下列说法不正确的是( )
A. 逐滴加入浓硫酸可提高ClO2的利用率
B. 装置④中所得产物中可能含有Na2SO4杂质
C. 从装置④反应后的溶液中获得晶体,可采用常压蒸发结晶
D. 制备NaClO2结束时,应关闭分液漏斗活塞,打开K1,关闭K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿的主要化学成分为CeFCO3,它是提取铈族稀土元素的重要矿物原料,二氧化铈(CeO2) 是一种重要的稀土氧化物。以氟碳铈矿为原料制备CeO2的一种工艺流程如下:
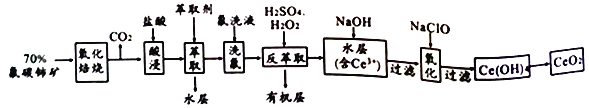
已知:①Ce 4+既能与F 结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+ 能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1) “氧化焙烧”的目的是______________。
(2)“酸浸”中会产生大量黄绿色气体、请写出CeO2与盐酸反应的离子方程式___________________;为避免产生上述污染,请提出一种解决方案________________________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce+(H2a-4A2a)+4H+。实验室中萃取时用到的主要玻璃仪器为______________;若缺少 “洗氟”,则所得产品的质量将_________(填“偏大”、“偏小”或 “不变”)。
Ce+(H2a-4A2a)+4H+。实验室中萃取时用到的主要玻璃仪器为______________;若缺少 “洗氟”,则所得产品的质量将_________(填“偏大”、“偏小”或 “不变”)。
(4) “反萃取”中,加稀硫酸和H2O2的作用__________________(用离子方程式表示)。
(5)取上述流程中得到的CeO2产品0.500g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不参加反应)消25.00mL标准溶液,该产品中CeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
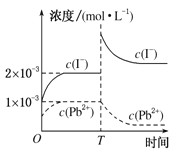
A.常温下,PbI2的Ksp为2×10-6
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变
C.T时刻改变的条件是升高温度,因而PbI2的Ksp增大
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液, PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:A(g)+B(g)![]() C(g)+D(g) ΔH<0。请回答下列问题:
C(g)+D(g) ΔH<0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(A)=1 mol/L,c(B)=2.4 mol/L,达到平衡时,A的转化率为60%,此时B的转化率为 。
(2)若反应温度降低,则B的转化率将 (填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(A)=4 mol·L-1,c(B)=a mol·L-1,达到平衡后c(C)=2 mol·L-1,则a= 。
(4)若反应温度不变,反应物的起始浓度分别为c(A)=c(B)=b mol/L,达到平衡后c(D)= 。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A. pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等
B. 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C. 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2、④NH3H2O三种溶液中NH4+的浓度:②>③>①>④
D. 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后
【答案】C
【解析】A、Ba(OH)2为强碱,抑制水的电离,Na2C03为强碱弱酸盐,CO32-结合水中的H+,从而促进水的电离,因此Na2C03溶液中水电离的c(OH)大,故A错误;B、溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),所以c(Na+)=c(Cl-)+c(CH3COO-),c(Na+)>c(Cl-),根据醋酸钠的物料守恒得c(Na+)=c(CH3COO-)+c(CH3COOH),所以(Cl-)=c(CH3COOH),c(Na+)>c(Cl-)=c(CH3COOH),故B错误;D、①NH4HCO3中NH4+水解呈酸性,HCO3水解呈碱性,促进NH4+的水解;②NH4HSO4在水溶液中完全电离出H+,抑制NH4+的水解;③NH4Fe(SO4)2中,Fe3+水解呈酸性,但Fe3+水解产生H+的浓度小,它对抑制NH4+的水解抑制程度小;④NH3H2O部分电离,产生的NH4+浓度比盐溶液中的小,故四种溶液中NH4+的浓度:②>③>①>④,故C正确;D、根据电荷守恒NaClO(aq)中c(Na+)+c(H+)=c(OH)+c(ClO),所以NaClO(aq)中离子总浓度为2[c(Na+)+c(H+)];根据电荷守恒NaCl(aq)中离子总浓度也为2[c(Na+)+c(H+)];等浓度的NaClO(aq)与NaCl(aq)中c(Na+)相同,NaClO溶液中ClO-水解,溶液呈碱性,c(OH)>c(H+),c(H+)<![]() ,而NaCl(aq)中,c(OH)=c(H+)=
,而NaCl(aq)中,c(OH)=c(H+)=![]() ,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
【题型】单选题
【结束】
17
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com