
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A. pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等
B. 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C. 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2、④NH3H2O三种溶液中NH4+的浓度:②>③>①>④
D. 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后
【答案】C
【解析】A、Ba(OH)2为强碱,抑制水的电离,Na2C03为强碱弱酸盐,CO32-结合水中的H+,从而促进水的电离,因此Na2C03溶液中水电离的c(OH)大,故A错误;B、溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),所以c(Na+)=c(Cl-)+c(CH3COO-),c(Na+)>c(Cl-),根据醋酸钠的物料守恒得c(Na+)=c(CH3COO-)+c(CH3COOH),所以(Cl-)=c(CH3COOH),c(Na+)>c(Cl-)=c(CH3COOH),故B错误;D、①NH4HCO3中NH4+水解呈酸性,HCO3水解呈碱性,促进NH4+的水解;②NH4HSO4在水溶液中完全电离出H+,抑制NH4+的水解;③NH4Fe(SO4)2中,Fe3+水解呈酸性,但Fe3+水解产生H+的浓度小,它对抑制NH4+的水解抑制程度小;④NH3H2O部分电离,产生的NH4+浓度比盐溶液中的小,故四种溶液中NH4+的浓度:②>③>①>④,故C正确;D、根据电荷守恒NaClO(aq)中c(Na+)+c(H+)=c(OH)+c(ClO),所以NaClO(aq)中离子总浓度为2[c(Na+)+c(H+)];根据电荷守恒NaCl(aq)中离子总浓度也为2[c(Na+)+c(H+)];等浓度的NaClO(aq)与NaCl(aq)中c(Na+)相同,NaClO溶液中ClO-水解,溶液呈碱性,c(OH)>c(H+),c(H+)<![]() ,而NaCl(aq)中,c(OH)=c(H+)=
,而NaCl(aq)中,c(OH)=c(H+)=![]() ,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
【题型】单选题
【结束】
17
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡标志的是
2C(g)达到平衡标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a molA,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2
A. ⑤⑥B. ⑦④C. ①③D. ②⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1(T1=25℃)和T2时,水溶液中水的离子积曲线如图所示:下列判断错误的是( )

A. T2>25℃ B. x=1.0×10﹣7
C. KW(a)=KW(d) D. b点溶液呈碱性,c点溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A. pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等
B. 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C. 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2、④NH3H2O三种溶液中NH4+的浓度:②>③>①>④
D. 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
【答案】C
【解析】A、根据电离平衡常数知,酸性H2CO3>HCN>HCO3-,结合强酸制取弱酸知,氰化钠溶液中通入少量CO2只能发生以下反应CN﹣+H2O+CO2=HCN+ HCO3-,故A错误;B、NaCN溶液显碱性,HCN溶液显酸性,选项中没有已知混合时NaCN与HCN量的相对大小,无法判断溶液的酸碱性,也无法判断离子浓度大小,故B错误;C、HCN的电离常数K与CN的水解常数Kh的乘积等于Kw,则有Kh=![]() ≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
【题型】单选题
【结束】
19
【题目】室温下,向20.00 mL 0.8molL﹣1一元酸HA溶液中滴入0.8 molL﹣1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
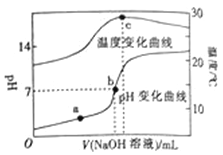
A. 常温下,1.0 molL﹣1HA的溶液的pH=0
B. a、b、c三点,a点混合溶液中c(Na+)最大
C. a、b两点的溶液中水的离子积Kw(a)=Kw(b)
D. c点时消耗NaOH溶液的体积为20.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有HCO3﹣、Na+、Ba2+、NO3﹣4种离子,若向其中加入少量Na2O2固体后溶液中离子浓度基本保持不变的是( )
A.HCO3﹣
B.Na+
C.Ba2+
D.NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的图解表示构成细胞的元素、化合物及其作用,a.b.c.d代表不同的小分子物质,A.B.C代表不同的大分子,请分析回答下列问题:
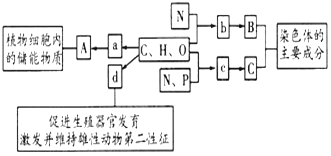
(1)物质a是_______,在动物细胞内,与物质A作用最相近的物质是_______。若物质A在动物、植物细胞均可含有,并作为细胞内的最理想的储存能量的物质,不仅能量多而且体积较小,则A是_________。
(2)物质d是________,化学本质是一种_________。同属于此类的还有胆固醇,其作用是构成__________的重要成分,在人体内还参与_______运输。
(3)物质b是________,若某种B分子含有2条链,由18个b分子(平均相对分子质量为128)组成的组成,则该B分子的相对分子质量大约为__________。
(4)物质c在人体细胞中共有_____种,分子中__________不同,决定了c的种类不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1的一元酸HA与0.1 mol·L-1的NaOH溶液等体积混合后,所得溶液pH>7,下列说法正确的是
A.混合前一元酸HA的c(H+)=0.1 mol·L-1
B.该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.HA在水溶液中的电离方程式:HA = H+ + A-
D.该混合溶液中:c(A-)+ c(HA)=0.1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com