
【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
【答案】C
【解析】A、根据电离平衡常数知,酸性H2CO3>HCN>HCO3-,结合强酸制取弱酸知,氰化钠溶液中通入少量CO2只能发生以下反应CN﹣+H2O+CO2=HCN+ HCO3-,故A错误;B、NaCN溶液显碱性,HCN溶液显酸性,选项中没有已知混合时NaCN与HCN量的相对大小,无法判断溶液的酸碱性,也无法判断离子浓度大小,故B错误;C、HCN的电离常数K与CN的水解常数Kh的乘积等于Kw,则有Kh=![]() ≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
≈1.6×10-5,故C正确;D、等体积等浓度的NaCN溶液与HCN溶液混合所得溶液的物料守恒为:2c(Na+)=c(CN)+c(HCN),而选项中没有已知NaCN与HCN量的相对大小,无法判断,故D错误。故选C。
【题型】单选题
【结束】
19
【题目】室温下,向20.00 mL 0.8molL﹣1一元酸HA溶液中滴入0.8 molL﹣1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
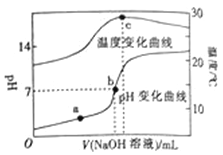
A. 常温下,1.0 molL﹣1HA的溶液的pH=0
B. a、b、c三点,a点混合溶液中c(Na+)最大
C. a、b两点的溶液中水的离子积Kw(a)=Kw(b)
D. c点时消耗NaOH溶液的体积为20.00mL
【答案】D
【解析】HA与NaOH恰好反应时,反应放热最多,溶液的温度最高。由图可知c点溶液的温度最高,则c点时,HA与NaOH恰好反应生成NaA,而此时溶液pH大于7,说明NaA为强碱弱酸盐,所以HA为弱酸;A、弱酸在溶液中部分电离,所以常温下,1.0molL1HA的溶液中c(H+)小于1mol/L,则pH大于0,故A错误;B、Na+不发生水解,所加NaOH体积越大,所得溶液c(Na+)越大,故三点中c点c(Na+)最大,故B错误;C、升高温度促进水的电离,水的电离常数增大,b点温度高于a点,所以水的离子积Kw(a)>Kw(b),故C错误;D、c点时,HA与NaOH恰好反应,所以向20.00mL0.8mol/L一元酸HA溶液中滴入0.8mol/L的NaOH溶液,消耗NaOH为20mL,故D正确。故选D。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
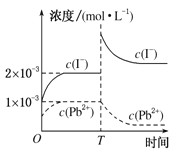
A.常温下,PbI2的Ksp为2×10-6
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变
C.T时刻改变的条件是升高温度,因而PbI2的Ksp增大
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液, PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图有关物质转化关系中,各物质均是初中化学常见的物质,其中A为红色金属单质,B能参与植物的光合作用。C、D为黑色粉末,F为可用于改良酸性土壤的碱,G为难溶性物质,H为难溶性蓝色物质(图中部分生成物已省略)。

(1)用化学式表示: D________,G___________;
(2)写出E与F反应的化学方程式________________________;
(3)光合作用生成的淀粉在人体内变成葡萄糖(C6H12O6),葡萄糖在酶的催化作用下发生缓慢氧化,同时放出热量,写出葡萄糖发生缓慢氧化反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3:2:1时,三种溶液的体积比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A. pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等
B. 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C. 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2、④NH3H2O三种溶液中NH4+的浓度:②>③>①>④
D. 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后
【答案】C
【解析】A、Ba(OH)2为强碱,抑制水的电离,Na2C03为强碱弱酸盐,CO32-结合水中的H+,从而促进水的电离,因此Na2C03溶液中水电离的c(OH)大,故A错误;B、溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CH3COO-),所以c(Na+)=c(Cl-)+c(CH3COO-),c(Na+)>c(Cl-),根据醋酸钠的物料守恒得c(Na+)=c(CH3COO-)+c(CH3COOH),所以(Cl-)=c(CH3COOH),c(Na+)>c(Cl-)=c(CH3COOH),故B错误;D、①NH4HCO3中NH4+水解呈酸性,HCO3水解呈碱性,促进NH4+的水解;②NH4HSO4在水溶液中完全电离出H+,抑制NH4+的水解;③NH4Fe(SO4)2中,Fe3+水解呈酸性,但Fe3+水解产生H+的浓度小,它对抑制NH4+的水解抑制程度小;④NH3H2O部分电离,产生的NH4+浓度比盐溶液中的小,故四种溶液中NH4+的浓度:②>③>①>④,故C正确;D、根据电荷守恒NaClO(aq)中c(Na+)+c(H+)=c(OH)+c(ClO),所以NaClO(aq)中离子总浓度为2[c(Na+)+c(H+)];根据电荷守恒NaCl(aq)中离子总浓度也为2[c(Na+)+c(H+)];等浓度的NaClO(aq)与NaCl(aq)中c(Na+)相同,NaClO溶液中ClO-水解,溶液呈碱性,c(OH)>c(H+),c(H+)<![]() ,而NaCl(aq)中,c(OH)=c(H+)=
,而NaCl(aq)中,c(OH)=c(H+)=![]() ,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
,所以NaClO(aq)中c(H+)小于NaCl(aq)中c(H+),所以等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后,故D错误。故选C。
【题型】单选题
【结束】
17
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只要用一种试剂,可区别NaCl、MgSO4、FeCl2、FeCl3四种溶液,这种试剂是( )
A.HCl
B.NaOH
C.AgNO3
D.BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的结构如下,下列有关X的说法正确的是( )
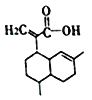
A. X的分子式为C15H24O2
B. 1molX最多可以和3molH2发生加成反应
C. X能发生取代反应和加成反应
D. X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使Na2S溶液中c(Na+)/c(S2-)的比值变小,可采取的措施是( )
①适量盐酸 ②适量NaOH(s) ③适量KOH(s) ④适量KHS(s) ⑤加水 ⑥适量Cl2溶液⑦加热
A. ②③④ B. ①②⑤⑥⑦
C. ②③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com