
【题目】利用下图所示装置模拟工业NaClO3与Na2SO3在浓H2SO4存在下制备ClO2,并以ClO2为原料制备NaClO2(已知:高于60℃时,NaClO2分解生成NaClO3和NaCl)。
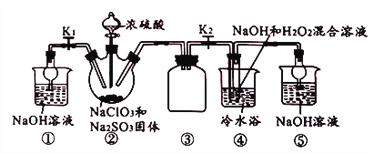
下列说法不正确的是( )
A. 逐滴加入浓硫酸可提高ClO2的利用率
B. 装置④中所得产物中可能含有Na2SO4杂质
C. 从装置④反应后的溶液中获得晶体,可采用常压蒸发结晶
D. 制备NaClO2结束时,应关闭分液漏斗活塞,打开K1,关闭K2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )

选项 物质 | a | b | c |
A | Al | AlCl3 | Al(OH)3 |
B | HNO3 | NO | NO2 |
C | Si | SiO2 | H2SiO3 |
D | S | SO2 | H2SO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
_______________________________________________________。
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)COCl2(g)△H < 0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0~6min内,反应的平均速率v(Cl2)=_______;
②该反应第一次达平衡时的平衡常数为__________,10min改变的条件是______。
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是___________________________________。

(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的___极,电解时阳极的电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,20g氖气所含有的原子数目为0.5NA
B. 2.8铁粉与50mL4 mol·L-1盐酸完全反应转移电子的数目为0.1NA
C. 标准状况下,22.4 LSO2和SO3混合物中含有的硫原子数目为0.1NA
D. 28g的C2H4和N2混合气体中含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒半径由小到大的排列顺序正确的是( )
A.Na<Si<PB.O2->Mg2+>Al3+
C.Ca>Ba>Ca2+D.Cl->F>F-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应C(s)+O2(g)=CO2(g)来说,下列有关说法正确的是( )
A. 增加固体碳的物质的量,化学反应速率会加快
B. 升高温度,化学反应速率会加快
C. 升高温度,化学反应速率会变慢
D. 升高温度,固体碳能充分燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡标志的是
2C(g)达到平衡标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a molA,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2
A. ⑤⑥B. ⑦④C. ①③D. ②⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图回答下列问题:
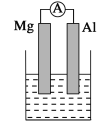
(1)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应方程式为______。
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:A、B两个电极均由多孔的碳块组成。该电池的正极反应式为:___________________________。
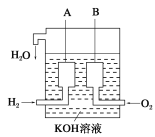
(3)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1(T1=25℃)和T2时,水溶液中水的离子积曲线如图所示:下列判断错误的是( )

A. T2>25℃ B. x=1.0×10﹣7
C. KW(a)=KW(d) D. b点溶液呈碱性,c点溶液呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com