
【题目】对于化学反应C(s)+O2(g)=CO2(g)来说,下列有关说法正确的是( )
A. 增加固体碳的物质的量,化学反应速率会加快
B. 升高温度,化学反应速率会加快
C. 升高温度,化学反应速率会变慢
D. 升高温度,固体碳能充分燃烧
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
【题目】在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
【答案】C
【解析】①1mol N≡N键断裂的同时,有6mol N-H键断裂,说明正逆反应速率相等,反应达到了平衡状态,故①选;②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1,因未说明二者表示的是正反应速率还是逆反应速率,则不能说明正逆反应速率相等,反应不一定达到平衡状态,故②不选;③根据质量守恒可知,该反应在反应前后质量不变,又因容器恒容,所以反应体系的密度始终不变,则体系气体密度不再改变不能说明反应达到平衡状态,故③不选;④NH3、N2、H2的体积分数都不再改变,说明正逆反应速率相等,反应达到了平衡状态,故④选;⑤因该反应是在恒容隔热容器中进行,则体系温度不再改变,说明反应达到了平衡状态,故⑤选,综上所述,答案选C。
【题型】单选题
【结束】
18
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A. KSP(AB2)小于KSP(CD),说明AB2的溶解度小于CD的溶解度
B. AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
C. 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)>Ksp(AgBr)
D. 将0.001 mol·L-1 的AgNO3溶液与0.001 mol·L-1的KCl溶液等体积混合,无沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为_________,S、O、N三种元素的第一电离能由大到小的顺序为_________。
(2)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4] (NO3)2。其中NO3-中心原子的杂化轨道类型为_________,[Cu(NH3)4]NO3)2中存在的化学键类型除了极性共价键外,还有_________。
(3)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,CN-中提供孤电子对的原子是_________, lmol CN-中含有的π键的数目为_________。与CN-互为等电子体的离子有_________ (写出一种即可)
(4)CuSO4的熔点为560°C,,Cu(NO3)2的溶点为115°C,CuSO4溶点更高的原因是_________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O ,其晶胞结构如图所示。
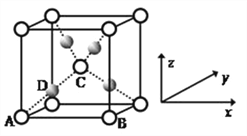
该晶胞原子坐标参数A为(0,0,0);B为(1,0,0) ;C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
)。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
②已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是_________,该晶胞中Cu原子的空间利用率是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序正确的是( )
A.热稳定性:H2O>HF>H2SB.最高正化合价:F>N>C
C.酸性:H2CO3>H3PO4>H2SO4D.非金属性:Cl>S>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置模拟工业NaClO3与Na2SO3在浓H2SO4存在下制备ClO2,并以ClO2为原料制备NaClO2(已知:高于60℃时,NaClO2分解生成NaClO3和NaCl)。
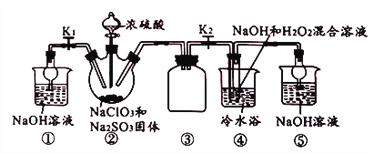
下列说法不正确的是( )
A. 逐滴加入浓硫酸可提高ClO2的利用率
B. 装置④中所得产物中可能含有Na2SO4杂质
C. 从装置④反应后的溶液中获得晶体,可采用常压蒸发结晶
D. 制备NaClO2结束时,应关闭分液漏斗活塞,打开K1,关闭K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气主要含有CO2 、CO、SO2、NOx 等物质,尾气中CO、氢氧化物(NOx) 严重影响人们的生活和健康,化学工作者对氮氧化物的处理做了广泛而深入的研究。
(1)利用甲烷还原NOx
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mo l;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+H2O(g) △H2=-1160kJ/mo l,
甲烷直接将NO2还原为N2的热化学方程式为________________________________。
(2)将不同量的CO(g)积H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 4 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为/span>_________(保留两位有效数字,下同)。
②该反应为________(填“吸热”或“放热”) 反应,实验2条件下的平衡常数K=________。
③若达平衡状态时,实验2 与实验3中各物质的质量分数分别相等,且t<4min,则a、b应满足的关系是_________________________(用含a、b的数学式表示)。
(3)CO分析仪的传感器可测定汽车尾气是否符合排放标准。该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3) 和氧化锆(ZrO2) 晶体,能传导O2-,则负极的电极反应式为____________。
(4)SO2可用钙基固硫反应除去,反应生成的CaSO4是一种微溶物质,其Ksp=9.0×10-6。若将浓度为2×10-3mol/L的Na2SO4溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
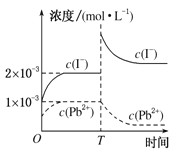
A.常温下,PbI2的Ksp为2×10-6
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变
C.T时刻改变的条件是升高温度,因而PbI2的Ksp增大
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液, PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在0.5L密闭容器中,某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:
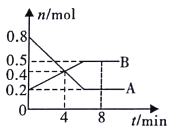
(1)该反应的化学方程式为_____________;
(2)若降低温度,v(逆)__;(填“加快”“减慢”或“不变”)
(3)第4min时,正、逆反应速率的大小关系为:v(正)__v(逆);(填“>”、“<”或“=”)
(4)以下措施能加快反应速率的是__。
A.恒温恒容充入He使压强增大 B.缩小体积,使压强增大
C.恒温恒压充入He D.平衡后加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同浓度的NaCl、MgCl2、AlCl3溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3:2:1时,三种溶液的体积比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com