
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,20g氖气所含有的原子数目为0.5NA
B. 2.8铁粉与50mL4 mol·L-1盐酸完全反应转移电子的数目为0.1NA
C. 标准状况下,22.4 LSO2和SO3混合物中含有的硫原子数目为0.1NA
D. 28g的C2H4和N2混合气体中含有的原子数为2NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法错误的是( )
A. 18g重甲基(-CD3)中含有的电子数为9NA
B. 22.4L(标准状况)CH2Cl2中含C-H键数为2NA
C. 10g34%H2O2溶液与足量的酸性KMnO4溶液充分反应,转移的电子数为0.2NA
D. 0.1mol由乙烯与乙醇组成的混合物完全燃烧所消托的氧气分子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg[c(H+)/c(OH-)]随加入NaOH的物质的量的变化如图所示。下列叙述正确的是( )
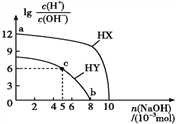
A. HX的酸性弱于HY B. c点溶液中:c(Y-)>c(HY)
C. a点由水电离出的c(H+)=10-12 mol·L-1 D. b点时酸碱恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为_________,S、O、N三种元素的第一电离能由大到小的顺序为_________。
(2)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4] (NO3)2。其中NO3-中心原子的杂化轨道类型为_________,[Cu(NH3)4]NO3)2中存在的化学键类型除了极性共价键外,还有_________。
(3)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,CN-中提供孤电子对的原子是_________, lmol CN-中含有的π键的数目为_________。与CN-互为等电子体的离子有_________ (写出一种即可)
(4)CuSO4的熔点为560°C,,Cu(NO3)2的溶点为115°C,CuSO4溶点更高的原因是_________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O ,其晶胞结构如图所示。
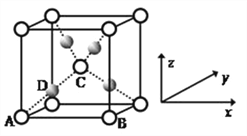
该晶胞原子坐标参数A为(0,0,0);B为(1,0,0) ;C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
)。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
②已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是_________,该晶胞中Cu原子的空间利用率是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,产生氢气速度最快的是( )
A.常温下铝与6mol/L的硝酸B.常温下镁与3mol/L的醋酸
C.常温下铁与3mol/L的盐酸D.常温下镁与3mol/L的硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序正确的是( )
A.热稳定性:H2O>HF>H2SB.最高正化合价:F>N>C
C.酸性:H2CO3>H3PO4>H2SO4D.非金属性:Cl>S>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置模拟工业NaClO3与Na2SO3在浓H2SO4存在下制备ClO2,并以ClO2为原料制备NaClO2(已知:高于60℃时,NaClO2分解生成NaClO3和NaCl)。
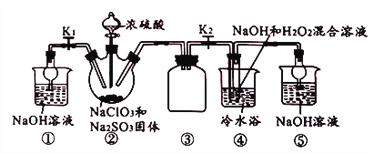
下列说法不正确的是( )
A. 逐滴加入浓硫酸可提高ClO2的利用率
B. 装置④中所得产物中可能含有Na2SO4杂质
C. 从装置④反应后的溶液中获得晶体,可采用常压蒸发结晶
D. 制备NaClO2结束时,应关闭分液漏斗活塞,打开K1,关闭K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
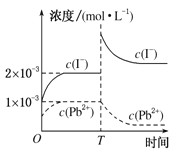
A.常温下,PbI2的Ksp为2×10-6
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变
C.T时刻改变的条件是升高温度,因而PbI2的Ksp增大
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液, PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图有关物质转化关系中,各物质均是初中化学常见的物质,其中A为红色金属单质,B能参与植物的光合作用。C、D为黑色粉末,F为可用于改良酸性土壤的碱,G为难溶性物质,H为难溶性蓝色物质(图中部分生成物已省略)。

(1)用化学式表示: D________,G___________;
(2)写出E与F反应的化学方程式________________________;
(3)光合作用生成的淀粉在人体内变成葡萄糖(C6H12O6),葡萄糖在酶的催化作用下发生缓慢氧化,同时放出热量,写出葡萄糖发生缓慢氧化反应的化学方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com