
【题目】垃圾渗滤液会污染地下水,为此科研人员设计了一种处理垃圾渗滤液并利用其进行发电的装置,该装置的工作原理如图所示。下列说法正确的是( )

A. 电池工作时,盐桥中的K+和Cl-不发生移动
B. 电池工作时,电子由Y极经导线流向X极
C. 电池工作时,X极和Y极周围溶液的pH均降低
D. 电池工作时,电池总反应为3NO3-+5NH3+3H+=4N2+9H2O
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A. C16H22O5 B. C14H16O4 C. C16H20O4 D. C14H18O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由含铜废料制铜的一种方案是:
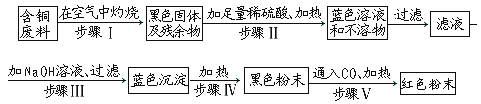
(1)写出下列步骤中的化学方程式:步骤Ⅲ:_________.步骤V:_________.
(2)步骤Ⅱ后形成的蓝色溶液中的溶质是_________.
(3)上述方案中可能造成空气污染的步骤是_________.
(4)若含铜废料的质量为a千克,黑色粉末的质量b千克,则该含铜废料中的含铜量为:___________(用含a,b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )

选项 物质 | a | b | c |
A | Al | AlCl3 | Al(OH)3 |
B | HNO3 | NO | NO2 |
C | Si | SiO2 | H2SiO3 |
D | S | SO2 | H2SO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宇宙飞船上常使用氢氧燃料电池,其电极总反应式为:2H2+O2=2H2O;若电解质溶液为KOH溶液,则下列叙述正确的是:
A. 此电池能见到浅蓝色火焰 B. H2为正极,O2为负极
C. 工作时电解液中OH-的物质的量不断增加 D. 电极反应中: H2失电子; O2得电子
【答案】D
【解析】A.该电池中氢气不燃烧,所以不能见到浅蓝色火焰,A错误;B.该原电池中,负极上通入氢气,正极上通入氧气,B错误;C.电池反应式为:2H2+O2=2H2O,根据方程式知,电解质溶液中氢氧根离子的物质的量不变,C错误;D.负极上电极反应式为:2H2+4OH--4e-=4H2O,正极上电极反应式为:O2+2H2O+4e-=4OH-,所以负极上氢气失电子,正极上氧气得电子,D正确;答案选D。
点睛:本题考查燃料电池,明确正负极上得失电子是解本题关键,难点是电极反应式的书写,电极反应式的书写要结合电解质溶液的酸碱性,有时还需要考虑交换膜以及是不是熔融的电解质等。
【题型】单选题
【结束】
21
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是 ( )
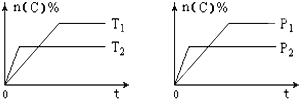
A. P1 > P2
B. 该反应的ΔH < 0
C. 化学方程式系数a>c+d
D. 使用催化剂,C的物质的量分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.由分子组成的物质都含有共价键
B.C(石墨,s) =C(金刚石,s),反应中既没有电子的得失也没有能量的变化
C.干冰升华时,二氧化碳分子中的共价键不发生断裂
D.伴有能量变化的物质变化,都是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
【答案】 CO32-+H2O HCO3-+OH- C>B>D>A c(Na+)>c(CN-)>c(OH-)>c(H+) B = <
【解析】(1). Na2CO3是强碱弱酸盐,碳酸根离子发生水解:CO32-+H2O HCO3-+OH-,使溶液呈碱性,故答案为:CO32-+H2O HCO3-+OH-;
(2).由表中数据可知,酸性强弱顺序为:CH3COOH> H2CO3> HCN>HCO3-,根据越弱越水解的规律可知,离子的水解程度:CO32->CN->HCO3->CH3COO-,则等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3四种溶液的pH由大到小的顺序为:C>B>D>A,故答案为:C>B>D>A;
(3).在25℃时,将HCN溶液与NaOH溶液等体积等浓度混合后,二者恰好完全反应,得到NaCN溶液,因Na+不水解而CN-水解,所以c(Na+)>c(CN-),CN-水解使溶液呈碱性,则c(OH-)>c(H+),因盐的水解反应是微弱的,则c(CN-)>c(OH-),所以此溶液中离子浓度由大到小的顺序是:c(Na+)>c(CN-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CN-)>c(OH-)>c(H+);
(4).A.常温下,0.1 mol·L-1的CH3COOH 溶液加水稀释,促进醋酸的电离,使醋酸电离平衡正向移动,n(H+)增大,但c(H+)和c(CH3COO-)减小,故A错误;B. 根据Ka= 可知,
可知, 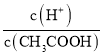 =
= 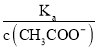 ,根据A项分析可知,c(CH3COO-)减小,因温度不变,则Ka不变,故
,根据A项分析可知,c(CH3COO-)减小,因温度不变,则Ka不变,故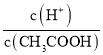 =
= 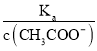 增大,故B正确;C. c(H+)·c(OH-)= Kw,因温度不变,则Kw不变,故c(H+)·c(OH-)也不变,故C错误;答案选B;
增大,故B正确;C. c(H+)·c(OH-)= Kw,因温度不变,则Kw不变,故c(H+)·c(OH-)也不变,故C错误;答案选B;
(5).pH相同的不同醋酸和盐酸中,氢离子浓度相同,反应刚开始时,与Zn反应速率的相同;因醋酸是弱酸,醋酸中酸的浓度大于氢离子浓度,盐酸中酸的浓度等于氢离子浓度,所以醋酸的浓度大于HCl的浓度,则所得氢气的质量:m(H2)盐酸<m(H2)醋酸,故答案为:=;<。
点睛:本题主要考查弱电解质的电离平衡和溶液中微粒浓度的大小比较,题目难度不大。本题的易错点是第(4)小问,分析时既要结合平衡移动原理,也要善于利用平衡常数只与温度有关进行判断,如比较c(H+)/c(CH3COOH)时,可以根据Ka=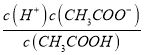 得出:
得出: 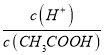 =
= 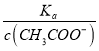 ,再根据c(CH3COO-)减小,因温度不变,则Ka不变,故
,再根据c(CH3COO-)减小,因温度不变,则Ka不变,故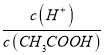 =
= 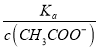 增大,可以快速解决此类问题。
增大,可以快速解决此类问题。
【题型】综合题
【结束】
25
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的化学试剂。
Ⅰ.测定中和热.
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式__________(中和热数值为57.3kJ/mol)。
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______(填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是__________________________。
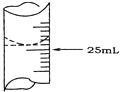
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为___________。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.22 | 26.31 |
(3)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________(小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高___________(填序号)。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定
D.滴定前俯视滴定管读数,滴定后平视滴定管读数
(5)滴定达到终点的标志是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
_______________________________________________________。
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)COCl2(g)△H < 0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0~6min内,反应的平均速率v(Cl2)=_______;
②该反应第一次达平衡时的平衡常数为__________,10min改变的条件是______。
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是___________________________________。

(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的___极,电解时阳极的电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡标志的是
2C(g)达到平衡标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a molA,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2
A. ⑤⑥B. ⑦④C. ①③D. ②⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com