
| △ |
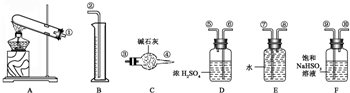
| △ |
| 6.08g |
| 152g/mol |
| 6.08g |
| 152g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、Na2S溶液呈碱性:S2-+2H2O?H2S+2OH- |
| C、向硝酸银溶液中逐滴滴入稀氨水至过量:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| D、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
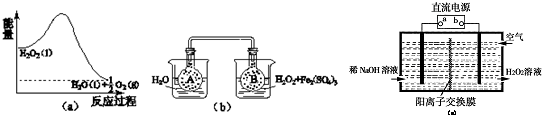
科目:高中化学 来源: 题型:

| 催化剂 |
| △ |
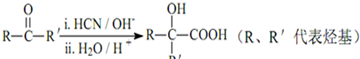
查看答案和解析>>
科目:高中化学 来源: 题型:
| 80℃,通电 |
| Ⅰ |
| 室温,KCl |
| Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 共价键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com