
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-akJ/mol,已知(a、b、c均大于零),下列说法正确的是( )
2HI(g) ΔH=-akJ/mol,已知(a、b、c均大于零),下列说法正确的是( )

A.反应物的总能量低于生成物的总能量
B.断开1molH—H键和1molI—I键所需能量大于断开2 molH—I键所需能量
C.断开2mol H—I键所需能量约为(c+b+a)kJ
D.向密闭容器中加入2molH2和2molI2,充分反应后放出的热量等于2akJ
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】将3mol/L NaOH溶液滴入到25mL 一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。椐图回答:
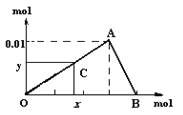
(1)当C点从O点向A点运动时,表示随OH-的不断加入,沉淀量逐渐________。OA曲线表示的离子反应是________________,由此可得A点的坐标为_______;
(2)当C点从A点向B点运动时,表示:_____。AB曲线表示的离子反应为:______,由此可得B点的坐标为:__________。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯、环氧乙院是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1=-206.6kJmo1-1
(g) △H1=-206.6kJmo1-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)反应III:△S(填“>”“<”或“=”)___0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJg-1,则△H3=___kJmol-1
(3)实验测得2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
①反应达到平衡后,仅降低温度,下列说法正确的是(________)
A.k正、k逆均增大,且k正增大的倍数更多
B.k正、k逆匀减小,且k正减小的倍数更少
C.k正增大、k逆减小,平衡正向移动
D.k正、k逆均减小,且k逆减小的倍数更少
②若在1L的密闭容器中充入1molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,经过10min反应达到平衡,体系的压强变为原来的0.875倍,则0~10min内v(O2)=___,![]() =___。
=___。
(4)现代制备乙烯常用乙烷氧化裂解法:
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
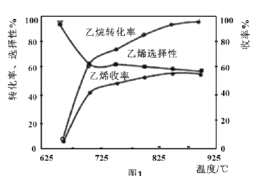
①乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填序号)。
A.650℃ B.700℃ C.850℃ D.900℃
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
②工业上,保持体系总压恒定为l00kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水,下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是( )
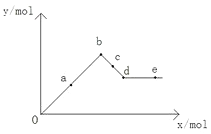
A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:Ba2+比AlO2-多
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子化物MCl(s)在水中溶解并发生电离,该过程的微观示意图如图。已知NA为阿伏伽德罗常数的值。下列相关说法正确的是( )
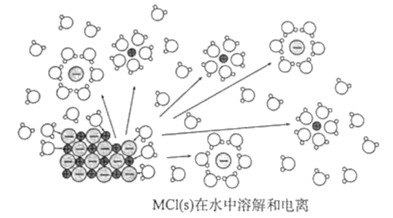
A.1molMCl中含有NA对共用电子对
B.MCl为弱电解质,在水中仅部分电离
C.M+和Cl-均与水分子中的氧原子结合形成水合离子
D.MCl在水作用下的溶解和电离过程是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,.当下列物理量不再发生变化时,不能表明反应:A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是( )
2C(g)+D(g)已达平衡状态的是( )
①气体的平均相对分子质量不再变化;②单位时间内生成amolA,同时消耗2amolC;③容器中的压强不再变化;④混合气体的密度不再变化;⑤B的浓度不再变化;⑥n(A):n(B):n(C):n(D)=1:3:2:2
A.②③⑤B.①③④⑥C.②④⑤D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
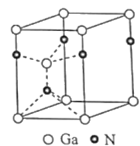
【题目】氮气、羟基乙胺(HOCH2CH2NH2)和氮化镓都含氮元素,其用途非常广泛。回答下列问题:
(1)基态氮原子价层电子排布图为___,其中电子能量最高的能级是___。
(2)HOCH2CH2NH2所含非金属元素电负性由大到小顺序为___,其中C和N的杂化方式均为___HOCH2CH2NH2中∠HOC小于∠HNC,其原因是___。
(3)HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中___区,该环状配离子的配位原子为___。
(4)氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的___(选填:八面体空隙、正四面体空隙、立方体空隙或三角形空隙);已知该晶胞底边边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶体的密度为___gcm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~111种元素在元素周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |||
一 | ① | ||||||||||
二 | ② | ③ | ④ | ⑤ | |||||||
三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||
四 | |||||||||||
请按要求回答下列问题:
(1)写出元素③形成单质的电子式______________
(2)画这11种元素中,非金属性最强的元素的原子结构示意图________________
(3)元素⑤④⑩分别和①形成的气体化合物中,最稳定的是(填化合物的化学式)__________
(4)元素⑨⑩的最高价氧化物的水化物中,酸性最强的是(填化合物的化学式)___________
(5)在盛有水的小烧杯中加入元素⑩的单质,发生反应的离子方程式____________________
(6)请从原子结构的角度解释,解释元素⑩的非金属性比元素强的原因_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧8.88g某有机物生成CO2和H2O,将燃烧后的气体通过浓H2SO4,浓H2SO4质量增加10.8g,剩余气体通过NaOH溶液,溶液质量增加21.12g。有机物蒸汽密度为3.3g/L(标准状况)。
(1)通过计算写出有机物的分子式。____
(2)若该物质与金属钠反应能放出H2,写出该有机物可能的结构简式。____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com