
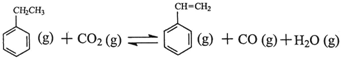
 △H
△H △H1=+117.6kJ·mol-1
△H1=+117.6kJ·mol-1 CO (g)+H2O (g) △H2=+41.2kJ·mol-1
CO (g)+H2O (g) △H2=+41.2kJ·mol-1 。
。| A.大于0.5mol/L | B.小于0.5mol/L |
| C.等于0.5mol/L | D.不确定 |
 ,则反应达到平衡时苯乙烯的浓度为 , (均用含
,则反应达到平衡时苯乙烯的浓度为 , (均用含 、P的表达式表示)。
、P的表达式表示)。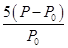 mol·L-1 (2分)
mol·L-1 (2分) 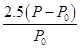 ×100%(2分)
×100%(2分) (2分)
(2分) +158.8kJ·mol-1。
+158.8kJ·mol-1。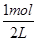 =0.5mol·L-1,QC=
=0.5mol·L-1,QC=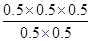 =0.5=K,所以该时刻化学反应是处于平衡状态;
=0.5=K,所以该时刻化学反应是处于平衡状态;
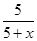 =
=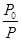
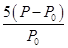 mol·L-1
mol·L-1 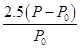 ×100%
×100% 。
。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源:不详 题型:单选题
 2H2(g)+O2(g) ΔH1
2H2(g)+O2(g) ΔH1 2HCl(g) ΔH2
2HCl(g) ΔH2 4HCl(g)+O2(g) ΔH3
4HCl(g)+O2(g) ΔH3| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
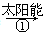 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2 mCeO2+xH2+xCO
mCeO2+xH2+xCOA.该过程中CeO2没有消耗 |
| B.该过程实现了太阳能向化学能的转化 |
| C.图中ΔH1=ΔH2+ΔH3 |
| D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1+Q2+Q3 | B.1.5Q1-0.5Q2+0.5Q3 |
| C.0.5Q1-1.5Q2+0.5Q3 | D.0.5(Q1+Q2+Q3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1 O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
 Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | 甲 | 乙 | CO | H2 |
| 燃烧热/(kJ·mol-1) | 1 366 | 5 518 | 283 | 286 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-y kJ·mol-1 | B.-(10x-y)kJ·mol-1 |
| C.-(5x-0.5y)kJ·mol-1 | D.+(10x-y)kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com