
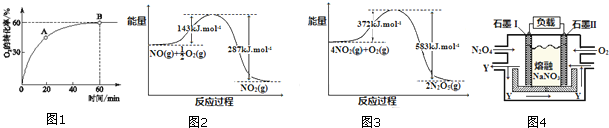
分析 (1)①A到B点氧气的转化率增大,说明反应正向进行;
②平衡时压强转化率为60%,当n(NO):n(O2)=4:1时设NO为4,O2为1,结合化学平衡三行计算得到;当达到B点后往容器中再以4:1加入些NO和 O2,相当于中等容器中气体压强,平衡正向进行;
③到达B点即达到平衡状态,正逆反应速率相同,各组分含量保持不变;
(2)依据图象分别写出对应反应的热化学方程式,结合盖斯定律计算4NO(g)+3O2(g)═2N2O5(g)反应的焓变;
(3)燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成氧化物N2O5的电极,再根据离子的放电顺序写出电极反应式.
解答 解:(1)①A到B点氧气的转化率增大,说明反应正向进行,A点的逆反应速率v逆 (O2)小于B点的正反应速率v正(O2),
故答案为:小于;
②平衡时压强转化率为60%,当n(NO):n(O2)=4:1时设NO为4,O2为1,则转化的氧气为0.6,结合化学平衡三行计算,
2NO(g)+O2(g)═2NO2(g)
起始量 4 1 0
变化量 1.2 0.6 1.2
平衡量 2.8 0.4 1.2
NO的平衡转化率$\frac{1.2}{4}$×100%=30%,
当达到B点后往容器中再以4:1加入些NO和 O2,相当于中等容器中气体压强,平衡正向进行,一氧化氮百分含量减小,NO的百分含量小于B点NO的百分含量,
故答案为:30%;小于;
③2NO(g)+O2(g)═2NO2(g)反应是气体体积进行的放热反应,
A.容器内气体颜色不再变化,说明二氧化氮浓度不变,反应达到平衡状态,故A正确;
B.速率之比等于化学方程式计量数之比为正反应速率之比,反应达到平衡状态v正(NO)=2v正(O2),故B正确;
C.达到平衡状态气体质量不变,物质的量不变,气体平均摩尔质量在此条件下达到最大,故C正确;
D.达到平衡状态,容器内气体密度不再变化,故D正确;
故答案为:ABCD;
(2)热化学方程式为①NO(g)+$\frac{1}{2}$O2(g)=NO2(g)△H=143KJ/mol-287KJ/mol=-144KJ/mol,
②4NO2(g)+O2(g)=2N2O5(g)△H=(372-583)KJ/mol=-211KJ/mol,
依据盖斯定律计算①×4+②得到4NO(g)+3O2(g)═2N2O5(g)△H=-787kJ/mol,
故答案为:-787kJ/mol;
(3)以N2O4、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,N2O4在负极失电子发生氧化反应,元素化合价升高为+5价,氧化物为N2O5,反应的电极反应为:N2O4+2NO3--2e-=2 N2O5,
故答案为:N2O5;N2O4+2NO3--2e-=2 N2O5.
点评 本题综合考查图象分析、化学平衡影响因素、平衡标志的判断、平衡计算、热化学方程式书写、原电池原理等知识点,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,本题注意把握化学平衡的计算方法,答题时把握做题思路,难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
将1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是1∶2
B.该浓硝酸中HNO3的物质的量浓度是14.0 mo l·L-1
l·L-1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
一定物质的量的锌与稀HNO3反应,若硝酸的还原产物为N2O,反应结束后锌无剩余,则参加反应的HNO3中被还原的HNO3与未被还原的HNO3的物质的量之比是( )
A.1∶4 B.1∶5 C.2∶3 D.2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.2K+2H2O=2KOH+H2↑
B.Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3
C.2Cu(NO3)2=2CuO+4NO2↑ +O2↑
D.3CO+Fe2O3=2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
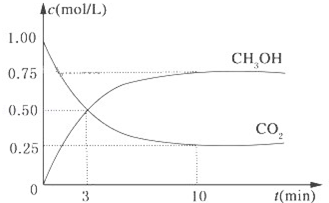 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
| 实验装置 | ① | ③ |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

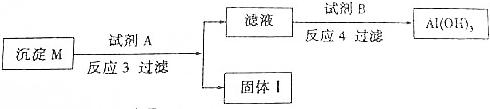
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
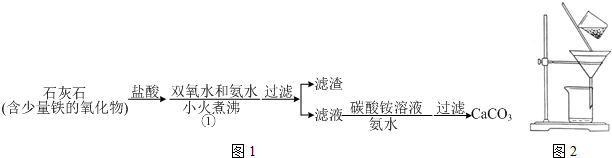
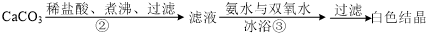
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com