
【题目】 有机物Y是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:
有机物Y是一种治疗心血管和高血压的药物,某研究小组以甲苯、乙烯等物质为主要原料,通过以下路线合成:

已知:RX+NaCN![]() RCN
RCN![]() RCOOH
RCOOH

请回答:
(1)Y的化学式为______________
(2)写出化合物H的结构简式_______________。
(3)下列说法不正确的是______________。
A.B的一氯代物有三种
B.反应①②③④均属于取代反应
C.化合物G→Y的转化过程中,涉及的反应类型有取代反应、加成反应
D.反应①的试剂与条件为Cl2/光照
E. 化合物E能发生银镜反应
(4)写出反应④的化学方程式________________。
(5)芳香族化合物M是B的同分异构体,M含有二个六元环(且两个二元环共用两个相邻的碳原子),则M可能的结构有_______________。(任写两种)
(6)已知一个碳原子上连有两个羟基是不稳定的,会脱水转化为羰基。:![]() .写出以
.写出以![]() 为原料制备合成
为原料制备合成 的线路图。___________
的线路图。___________
【答案】C11H14NCl  ACE
ACE 
![]() (其他合理的均给分)
(其他合理的均给分) 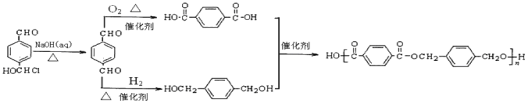
【解析】
甲苯发生反应①生成A,A和NaCN反应后再水解生成B,B发生反应②生成C,结合C的结构简式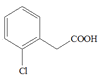 可知,A的结构简式为
可知,A的结构简式为![]() ,B的结构简式为
,B的结构简式为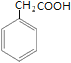 ,根据D和G的结构的结构简式可知,D和F发生反应④生成G,且是F的氨基中的氢原子和D中的氯原子发生取代反应,比较G和X的结构简式,可推出H的结构简式为
,根据D和G的结构的结构简式可知,D和F发生反应④生成G,且是F的氨基中的氢原子和D中的氯原子发生取代反应,比较G和X的结构简式,可推出H的结构简式为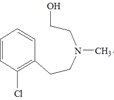 ,G发生还原反应生成H,H发生取代反应生成X,X发生取代反应生成Y,以此解答。
,G发生还原反应生成H,H发生取代反应生成X,X发生取代反应生成Y,以此解答。
(1)Y的结构简式为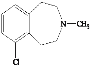 ,则Y的化学式为C11H14NCl;
,则Y的化学式为C11H14NCl;
故答案为:C11H14NCl;
(2)比较G和X的结构简式,可推出H的结构简式为 ;
;
故答案为: ;
;
(3)A.B的结构简式为 ,其一氯代物有4种 ,故A错误;
,其一氯代物有4种 ,故A错误;
B.由合成路线图可知,反应①②③④均属于取代反应,故B正确;
C.从G→Y的转化过程中,涉及的反应类型有还原反应、取代反应,故C错误;
D.根据C的结构简式可知反应①是甲基上的氢原子被取代,因此试剂与条件为Cl2/光照,故D正确;
E. 化合物E是环氧乙烷,不含醛基,不能发生银镜反应,故E错误。
故答案为:ACE;
(4)反应④是氯原子被取代,反应的化学方程式为: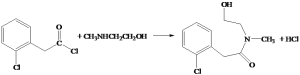 ;
;
故答案为: ;
;
(5)B的结构简式为 ,芳香族化合物M是B的同分异构体,M含有二个六元环,则符合条件的有机物结构简式为:
,芳香族化合物M是B的同分异构体,M含有二个六元环,则符合条件的有机物结构简式为: ![]() ;
;
故答案为:![]() ;
;
(6)制备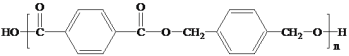 ,应先合成对苯二甲酸和对苯二甲醇;以
,应先合成对苯二甲酸和对苯二甲醇;以![]() 为原料,
为原料,![]() 水解可生成对苯二甲醛,分别氧化和还原可生成对苯二甲酸和对苯二甲醇,其合成流程图为:
水解可生成对苯二甲醛,分别氧化和还原可生成对苯二甲酸和对苯二甲醇,其合成流程图为: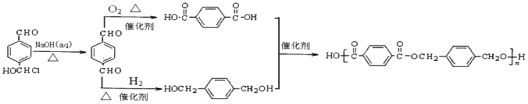 ;
;
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】己知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是( )

A. a、c两元素的最高正价一定相等
B. d的原子序数不可能是b的原子序数的3倍
C. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性
D. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池总反应离子方程式为:2Fe3++Fe = 3Fe2+,能实现该反应的原电池是( )
A. 正极为Cu,负极为Fe,电解质溶液为FeCl2
B. 正极为C,负极为Fe,电解质溶液为Fe(NO3)3
C. 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3
D. 正极为Ag,负极为Fe,电解质溶液为CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是( )

A. 常温下,0.1 mol·L-1氨水中NH3·H2O的电离常数K约为1×10-5
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)=c(Cl-)
D. d点代表两溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g) ![]() eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是
eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是

A. 到平衡后,加入催化剂则C%增大
B. 化学方程式中n<e+f
C. 达到平衡后,若升温,平衡左移
D. 达到平衡后,增加A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,HCOOH(甲酸)比NH3H2O电离常数大。向10 mL 0.1mol/L HCOOH中滴加同浓度的氨水,有关叙述正确的是( )
A. 滴加过程中水的电离程度始终增大
B. 当加入10 mL NH3H2O时,c(NH4+) > c(HCOO-)
C. 当两者恰好中和时,溶液pH = 7
D. 滴加过程中n(HCOOH)与n(HCOO-)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在元素周期表中,A、B均为前四周期主族元素,且A位于B的下一周期。某含氧酸盐X的化学式为ABO3。请回答:
(1)若常温下B的单质为黄绿色气体。
①A在元素周期表中的位置是_______________________。
②下列说法正确的是_________(填代号)。
a.A单质的熔点比B单质的熔点低
b.A的简单离子半径比B的简单离子半径大
c.A、B元素的最高价氧化物对应的水化物都是强电解质
d.化合物X中既含有离子键又含有共价键
③400℃时,X能发生分解反应生成两种盐,其物质的量之比为1∶3,其中一种是无氧酸盐。该反应的化学方程式为_____________________________________________。
(2)若X能与稀硫酸反应,生成无色、无味的气体。
①该气体分子的电子式为______________________。
②X在水中持续加热,发生水解反应,生成一种更难溶的物质并逸出气体,反应的化学方程式为__________________________________________。
③X可用作防火涂层,其原因是:a.高温下X发生分解反应时,吸收大量的热;
b. __________________________________________(任写一种)。
(3)若X难溶于水,在空气中易氧化变质,B元素原子的最外层电子数是其电子层数的2倍。X能快速消除自来水中的C1O-,该反应的离子方程式为______________________________________。
(4)用一个化学方程式证明上述(1)、(3)两种情况下化合物X中B元素非金属性强弱________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,则下列叙述正确的是( )
A.6.02×1022个H2SO4分子在水中可电离生成2NA个H+
B.在25℃,101kPa时,22.4L氢气中含有2NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5mol甲烷的质量比为7:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验,下列说法不正确的是( )

实验现象:
时间 | 试纸I | 试纸II |
lmin | a极附近试纸变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近试纸变蓝 |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
A. Na2SO4溶液中SO42-向a极和c极移动
B. a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH-
C. 试纸I的现象说明,此环境中H+的迁移速率比OH-快
D. 对比试纸I和试纸II的现象,说明电解质浓度和环境影响H+和OH-的迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com