
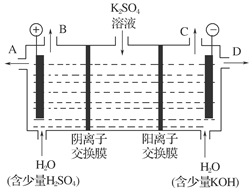


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.红色铁锈的主要成分是Fe(OH)3 |
| B.钢材在空气中的反应只有氧化反应、还原反应及化合反应 |
| C.钢材在空气中的腐蚀主要为电化学腐蚀,其负极的反应为:Fe-3e-=Fe3+ |
| D.空气中阳光、雨水、湿度对钢材的腐蚀有较大影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钢铁发生电化腐蚀的正极反应式:Fe-2e-="=" Fe2+[来 |
| B.为实现铁上镀铜,可让铁做阳极. |
| C.粗铜精炼时,与电源正极相连的是纯铜 |
| D.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-==Cl2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阳离子只能得到电子被还原,只能作氧化剂 |
| B.海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.为减少中和滴定实验的误差,锥形瓶必须洗净并烘干后使用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
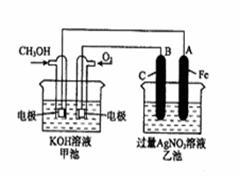
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2O的还原 |
| B.Ni(OH)2的还原 |
| C.H2的氧化 |
| D.Ni(OH)2的氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com