
【题目】下列关于物质的量浓度表述正确的是( )
A.0.3mol·L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.9mol
B.58.5gNaCl溶于1L水中配制成溶液,所得NaCl溶液的物质的量浓度为1mol/L
C.40gNaOH溶于水中配制成500mL的溶液,该溶液的物质的量浓度为2mol/L
D.50mL1mol·L-1的KCl溶液和100mL0.25mol·L-1MgCl2溶液中,Cl-物质的量浓度相等
【答案】C
【解析】
A.根据n=cV,溶液的体积未知,无法计算0.3mol·L-1 Na2SO4溶液溶质的物质的量,也无法确定含有的Na+和SO42-总物质的量,故A错误;
B.溶液的体积不等于溶剂的体积,则58.5gNaCl溶于1L水中配制成溶液,所得NaCl溶液的体积不是1L,则溶液的物质的量浓度不为1mol/L,故B错误;
C.40gNaOH的物质的量为1mol,溶于水中配制成500mL的溶液,该溶液的物质的量浓度为![]() =2mol/L,故C正确;
=2mol/L,故C正确;
D.50mL1mol·L-1的KCl溶液中Cl-物质的量浓度为1mol·L-1,而100mL0.25mol·L-1MgCl2溶液中Cl-物质的量浓度为0.5mol·L-1,不相等,故D错误;
故答案为C。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A、该反应的焓变为正值
B、恒温恒容下,增大压强,H2浓度一定减小
C、升高温度,逆反应速率减小
D、该反应化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下列四种溶液:①c(H+)=10-3mol·L-1的醋酸;②pH=5 的NH4Cl溶液; ③pH=10的Na2CO3溶液;④c(OH-)=10-3mol·L-1氨水溶液。由水电离出的氢离子浓度之比为 ( )
A. 1∶106∶10∶1 B. 1∶106∶107∶1
C. 108∶106∶10∶1 D. 108∶106∶107∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水质量是关系人类健康的重要问题。
(1)Cl2是最早用于饮用水消毒的物质,写出Cl2溶于水发生反应的离子方程式:___。
(2)ClO2是一种高效、低毒的消毒剂,逐渐取代Cl2成为生产自来水的消毒剂,工业上用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应中氧化剂与还原剂物质的量之比为____。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、ClO2氧化性更强,是无二次污染的绿色水处理剂。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾。由以上信息可知,相同条件下,高铁酸钠溶解度比高铁酸钾溶解度__(填“大”或“小”)。高铁酸钾溶于水放出氧气,能杀菌消毒,生成能吸附水中悬浮物的氢氧化铁胶体。用一个离子方程式表示高铁酸钾处理水的过程____。干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应的还原剂是___,每生成1molNa2FeO4转移__mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾[KAl(SO4)2·12H2O]的过程如图所示。下列说法正确的是( )

A.试剂①可选用NaOH溶液
B.过滤操作中使用的玻璃仪器只有漏斗、烧杯
C.滤液A到沉淀B的反应中有CO2生成
D.最后一步操作是蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。

(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。

a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。


铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用浓盐酸与氯酸钾固体反应制氯气时,发现所得气体颜色偏深,经分析该气体主要含有Cl2和ClO2两种气体,某研究性学习小组拟用如图所示装置分离制得的混合气体,并测定两种气体的物质的量之比。

Ⅰ.查阅资料:
常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不溶于浓硫酸、四氯化碳,有强氧化性,能与NaOH溶液反应生成等物质的量的两种盐,其中一种为 NaClO3。
Ⅱ.制备与分离:
(1)实验加药品前应进行的实验操作是____________。
(2)装置C、E的作用分别是 _________、_________。
(3)F中ClO2与NaOH 溶液反应的离子方程式为_____________。
Ⅲ.测量与计算:
反应结束后,测得B、C装置分别增重 2.0g和 14 .2g,将D中的液体溶于水,配成2.5 L溶液,取 25.00 mL该溶液,调节试样的pH﹤2.0 ,加入足量的 KI晶体,振荡后,静置片刻;加入指示剂X ,用 0.200mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25.00 mL 。(己知: 2ClO2+8H++10I-===5I2+2Cl-+4H2O;2Na2S2O3+I2===Na2S4O6 +2NaI )
(4)指示剂X为_____,滴定终点时的现象是_______________。
(5)原装置收集到的ClO2物质的量为___________。
Ⅳ.结论:
(6)浓盐酸与氯酸钾固体反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,0.1mol·L-lCH3COOH的电离度(已电离的CH3COOH分子数/原CH3COOH分子总数)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00 mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法正确的是

A. M点→N点,水的电离程度逐渐增大
B. 25℃时,CH3COOH 的电离常数约为1.0×10-2
C. N点溶液中,c(CH3COO-) =c(NH4+)=0.05 mol·L-l
D. 当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 Q、W、X、Y、Z原子序数依次增加,其中Q、W原子核外L 电子层的电子数分别为0、4,X、Y、Z在周期表中的位置如图所示。 下列说法不正确的是
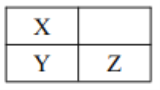
A. W、 X、 Q 的原子半径依次减小 B. Y 的最高价氧化物的水化物一定是强酸
C. W 和 Z 可能形成化合物W3Z8 D. Q、 X、 Z 可能形成离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com