
【题目】下列各项关系中正确的是
A.0.1mol/LNa2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)=0.2mol/L
B.常温下pH=a的稀H2SO4与pH=b的氨水等体积混合后恰好完全反应,则a+b<14
C.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH)
D.pH相同的三种溶液①NH4Cl,②(NH4)2SO4,③NH4HSO4,c(NH4+)大小关系为①>②>③
【答案】B
【解析】
A.0.1mol/LNa2SO3溶液中存在物料守恒:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)=0.2mol/L,A错误;
B.等体积完全反应要求氨水的浓度和H2SO4溶液中H+浓度相等,由于氨水中NH3·H2O没有完全电离,则10-amol/L>10b-14mol/L,即:a+b<14,B正确;
C.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,得到的溶液为CH3COOH、CH3COONa等浓度的混合溶液,溶液中存在电荷守恒:![]() ,存在物料守恒:
,存在物料守恒:![]() ,两式整理可得:
,两式整理可得:![]() ,C错误;
,C错误;
D.pH相同的![]() 和
和![]() 溶液的c(NH4+)相等,D错误;
溶液的c(NH4+)相等,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】氨气是一种重要化工原料。
(1)德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。
已知:①![]() △H=a kJ/mol
△H=a kJ/mol
②每破坏lmol有关化学键需要的能量如下表:
H-H | N-H | N≡N |
436kJ | 391kJ | 946k |
则a=_________________。
(2)下图为不同温度(T)、不同投料比[n(![]() )/n(
)/n(![]() )]时反应达到平衡时
)]时反应达到平衡时![]() 的转化率变化曲线。
的转化率变化曲线。

①![]() 、
、![]() 、
、![]() 、
、![]() 的大小关系为__________________。
的大小关系为__________________。
②保持温度和体积不变,提高投料比[n(![]() )/n(
)/n(![]() )],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
)],则重新达到平衡时,下列说法一定正确的是_______(填字母序号)。
A.![]() 的浓度增大
的浓度增大
B.![]() 的转化率增大
的转化率增大
C.![]() 的体积分数增大
的体积分数增大
D.![]() 的浓度减小
的浓度减小
③温度为![]() 时,向2L密闭容器中加入1.0mol
时,向2L密闭容器中加入1.0mol![]() 和1.0mol
和1.0mol![]() ,若5min后反应达到平衡,则用v(
,若5min后反应达到平衡,则用v(![]() )表示该反应的平均速率为____________________;反应在
)表示该反应的平均速率为____________________;反应在![]() 时的平衡常数K=________________。
时的平衡常数K=________________。
(3)一种新型除烟气中氮氧化物的方法是采用![]() 作还原剂还原烟气中的氮氧化物且产物无污染,写出
作还原剂还原烟气中的氮氧化物且产物无污染,写出![]() 还原
还原![]() 的化学反应方程式_____________________________________。
的化学反应方程式_____________________________________。
(4)若用标准盐酸测定某稀氨水的浓度,应选择__________作指示剂;滴定过程中眼睛注视_____________。已知稀氨水体积为25.0mL,滴定结束测得消耗0.0100mol/L盐酸的平均体积为20.0mL,则该氨水的浓度为________________(保留2位有效数字);若滴定前滴定管尖嘴有气泡,滴定后尖嘴无气泡,则测定结果________(填“偏大”、“偏小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向 ![]() 二元弱酸
二元弱酸 ![]() 溶液中滴加
溶液中滴加 ![]() 溶液,溶液中的
溶液,溶液中的 ![]() ,
,![]() ,
, ![]() 的物质的量分数
的物质的量分数![]()
![]() 随 pH的变化如图所示。下列说法错误的是
随 pH的变化如图所示。下列说法错误的是![]()
![]()
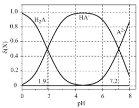
![]() 已知
已知
A.加入 ![]() 时,
时,![]()
B.当 ![]() ,
, ![]()
C.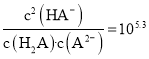
D.当混合溶液呈中性时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
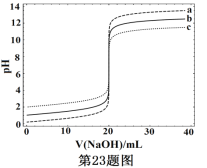
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、X、Y、Z五种短周期元素,原子序数逐渐增大。它们的性质或原子结构如表:
元素 | 性质或原子结构 |
A | 原子核内只有一个质子 |
B | 单质是空气中含最多的气体 |
X | 原子的最外层电子数是次外层电子数的3倍 |
Y | 短周期元素中原子半径最大的元素(除稀有气体外) |
Z | 最高正化合价与最低负化合物的代数和为6 |
(1)X的元素名称及在元素周期表中的位置:___、___。
(2)B、X、Y的原子半径由大到小的顺序为(用元素符号表示)___。
(3)W元素的核电荷数是B、X的核电荷数的和,则W与Z的氢化物稳定性为___>___(填化学式)。
(4)A、X两元素形成的原子个数比为2:1的化合物属于___晶体,写出该晶体与Z元素形成的单质反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+3B(g)![]() 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.02 mol/(L·s) B.v(B)=0.03 mol/(L·s)
C.v(B)=0.90 mol/(L·min) D.v(C)=0.60 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水钴矿中除SiO2外,还有9.24%CoO、2.78%Fe2O3、0.96%MgO、0.084%CaO。从中提取钴的主要工艺流程如下:
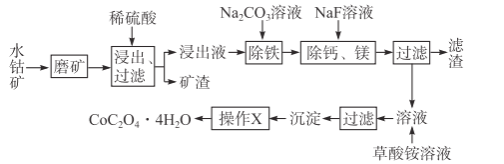
(1)浸出过程中,CoO溶解的离子反应方程式为___,矿渣的主要成分是___、___。
(2)请配平下列除铁的化学方程式:
_Fe2(SO4)3+_H2O+_Na2CO3=_Na2Fe6(SO4)4(OH)12↓+_Na2SO4+_CO2↑
(3)除钙、镁过程中,逐渐加入NaF溶液,当CaF2开始沉淀时,溶液中![]() =___。[已知Ksp(CaF2)=1.0×10-10、Ksp(MgF2)=7.4×10-11]。
=___。[已知Ksp(CaF2)=1.0×10-10、Ksp(MgF2)=7.4×10-11]。
(4)“操作X”是___。进行该操作的主要目的是除去沉淀中的杂质离子,检验杂质中的主要阴离子是否除净的试剂是___。
(5)100t水钴矿最多可获得___tCoC2O44H2O产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列装置完成系列实验,下列说法正确的是( )

A. 铜和浓硝酸的反应与铜和浓硫酸的反应一样需要加热条件下才能进行
B. BaCl2溶液中会出现白色沉淀BaSO3
C. H2S溶液中会出现黄色沉淀,体现了SO2的还原性
D. 为验证碳、硅非金属性的相对强弱,A试管中的试剂可以是KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com