
【题目】水钴矿中除SiO2外,还有9.24%CoO、2.78%Fe2O3、0.96%MgO、0.084%CaO。从中提取钴的主要工艺流程如下:
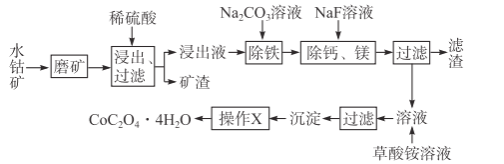
(1)浸出过程中,CoO溶解的离子反应方程式为___,矿渣的主要成分是___、___。
(2)请配平下列除铁的化学方程式:
_Fe2(SO4)3+_H2O+_Na2CO3=_Na2Fe6(SO4)4(OH)12↓+_Na2SO4+_CO2↑
(3)除钙、镁过程中,逐渐加入NaF溶液,当CaF2开始沉淀时,溶液中![]() =___。[已知Ksp(CaF2)=1.0×10-10、Ksp(MgF2)=7.4×10-11]。
=___。[已知Ksp(CaF2)=1.0×10-10、Ksp(MgF2)=7.4×10-11]。
(4)“操作X”是___。进行该操作的主要目的是除去沉淀中的杂质离子,检验杂质中的主要阴离子是否除净的试剂是___。
(5)100t水钴矿最多可获得___tCoC2O44H2O产品。
【答案】CoO+2H+=Co2++H2O SiO2 CaSO4 3 6 6 1 5 6 0.74 洗涤、干燥 BaCl2溶液 27.0
【解析】
水钴矿磨矿可将矿石粉碎,增大接触面积,加快反应速率,加入稀硫酸浸取过滤,滤液中含有:CoSO4、Fe2(SO4)3、MgSO4、CaSO4,矿渣为SiO2,、CaSO4;加入碳酸钠,除去Fe2(SO4)3,加入氟化钠,除去钙离子、镁离子,过滤得的滤液主要含CoSO4,加入草酸铵,通过沉淀、过滤、洗涤、干燥得到四水合草酸钴;
(1)氧化钴与硫酸反应生成硫酸钴和水;
(2)根据质量守恒定律即化学反应前后原子的种类和数目不变配平该方程式;
(3)已知Ksp(CaF2)=1.0×10-10、Ksp(MgF2)=7.4×10-11,因此逐渐加入NaF溶液过程中,先沉淀镁离子,后沉淀钙离子,当CaF2开始沉淀时,MgF2已经沉淀,则所得滤液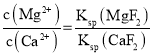 ;
;
(4)得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质;该沉淀吸附易溶于水的离子,根据流程图知,加入硫酸、碳酸钠、草酸铵的过程,溶液中引入硫酸根离子、铵根离子和钠离子,则杂质中的主要阴离子是硫酸根离子,根据硫酸根离子的检验选择试剂;
(5)根据Co元素守恒进行计算。
(1)水钴矿中除SiO2外,还有9.24%CoO,2.78%Fe2O3,0.96%MgO、0.084%CaO,加入稀硫酸溶解的是氧化铁、氧化镁、氧化钙、氧化钴,氧化钴溶解于硫酸反应的离子方程式为:CoO+2H+=Co2++H2O,二氧化硅不溶,生成的硫酸钙微溶,所以残渣为SiO2、CaSO4;
故答案为:CoO+2H+=Co2++H2O;SiO2;CaSO4;
(2)根据质量守恒定律即化学反应前后原子的种类和数目不变配平,首先根据Fe守恒,右边6个Fe,所以给Fe2(SO4)3前配3,在根据S守恒,给Na2SO4前配9-4=5,再根据Na守恒,给Na2CO3前配![]() ,最后根据C、H、O守恒配平方程式即可,所以其方程为3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑;
,最后根据C、H、O守恒配平方程式即可,所以其方程为3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑;
故答案为:3;6;6;1;5;6;
(3)已知Ksp(CaF2)=1.0×10-10、Ksp(MgF2)=7.4×10-11,因此逐渐加入NaF溶液过程中,先沉淀镁离子,后沉淀钙离子,当CaF2开始沉淀时,MgF2已经沉淀,则所得滤液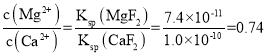 ;
;
故答案为:0.74;
(4)得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质;该沉淀吸附易溶于水的离子,根据流程图知,加入硫酸、碳酸钠、草酸铵的过程,溶液中引入硫酸根离子、铵根离子和钠离子,则杂质中的主要阴离子是硫酸根离子,检验硫酸根离子是否除尽的试剂是BaCl2溶液,取最后一次洗涤液于试管中,向其中滴加适量的BaCl2溶液,若无白色沉淀生成,说明阴离子硫酸根离子除净,沉淀洗涤干净;
故答案为:洗涤、干燥;BaCl2溶液;
(5)水钴矿中有9.24%CoO,则100t水钴矿中CoO质量=100t×9.24%=9.24t,依据钴元素守恒,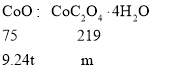
则可得比例式,![]() ,解得m=27.0t;
,解得m=27.0t;
故答案为:27.0。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.因为 SO2 具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色
B.向 50 mL 18.4 mol/L H2SO4 溶液中加入足量的铜片并加热,充分反应后,被还原的 H2SO4的物质的量小于 0.46 mol
C.SO2、NO2 和 CO2 都是引起酸雨的主要原因,导致雨水的 pH 小于 5.6
D.浓 HNO3 与浓盐酸按 3∶1 的体积比混合所得的混合物叫王水,能溶解金和铂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
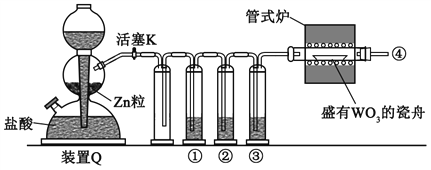
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项关系中正确的是
A.0.1mol/LNa2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)=0.2mol/L
B.常温下pH=a的稀H2SO4与pH=b的氨水等体积混合后恰好完全反应,则a+b<14
C.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH)
D.pH相同的三种溶液①NH4Cl,②(NH4)2SO4,③NH4HSO4,c(NH4+)大小关系为①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 苯和氯气生成C6H6Cl6的反应是取代反应
B. 乙烯与溴水发生加成反应的产物是CH2CH2Br2
C. 等物质的量的甲烷与氯气反应的产物是CH3Cl
D. 硫酸作催化剂,CH3CO18OCH2CH3水解所得乙醇分子中有18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴加到己二酸![]() 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是![]()
![]()
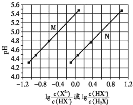
A.![]() 的数量级为
的数量级为![]()
B.曲线N表示pH与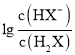 的变化关系
的变化关系
C.NaHX溶液中![]()
D.当混合溶液呈中性时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
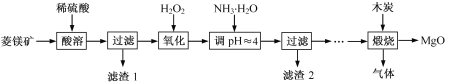
(1)MgCO3与稀硫酸反应的离子方程式为_______。
(2)加入H2O2氧化时,发生反应的化学方程式为_______。
(3)滤渣2 的成分是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.22.4L甲烷分子所含质子数为10NA
B.标准状况下,22.4L二氯甲烷的分子数约为NA个
C.1mol苯分子中含有的碳碳单键数为6NA
D.常温常压下,28.0g乙烯和丁烯的混合气体中含有的碳原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为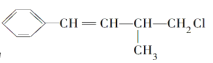 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A.1mol该有机物在加热和催化剂作用下,最多能与4molH2反应
B.该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C.该有机物在一定条件下能发生消去反应和取代反应
D.该有机物遇硝酸银溶液产生白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com