
【题目】现有A、B、X、Y、Z五种短周期元素,原子序数逐渐增大。它们的性质或原子结构如表:
元素 | 性质或原子结构 |
A | 原子核内只有一个质子 |
B | 单质是空气中含最多的气体 |
X | 原子的最外层电子数是次外层电子数的3倍 |
Y | 短周期元素中原子半径最大的元素(除稀有气体外) |
Z | 最高正化合价与最低负化合物的代数和为6 |
(1)X的元素名称及在元素周期表中的位置:___、___。
(2)B、X、Y的原子半径由大到小的顺序为(用元素符号表示)___。
(3)W元素的核电荷数是B、X的核电荷数的和,则W与Z的氢化物稳定性为___>___(填化学式)。
(4)A、X两元素形成的原子个数比为2:1的化合物属于___晶体,写出该晶体与Z元素形成的单质反应的化学方程式___。
【答案】氧 第二周期第VIA族 Na>N>O HCl PH3 分子 Cl2+H2O ![]() HCl+HClO
HCl+HClO
【解析】
A、B、 X、Y、Z五种短周期元素,原子序数逐渐增大,A元素原子核内只有一个质子,则A为H元素;B单质是空气中含最多的气体,则B为N元素;X原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;Y是短周期元素中原子半径最大的元素(除稀有气体外),则Y为Na元素;Z最高正化合价与最低负化合物的代数和为6,最高正化合价为+7,原子序数最大,故Z为Cl元素。
(1)由分析可知,X元素名称为氧,位于周期表中第二周期第VIA族;
(2)同周期自左而右原子半径依次减小,同主族自上而下原子半径依次增大,故原子半径:Na>N>O;
(3)W元素的核电荷数是N(核电荷数为7)、O(核电荷数为8)的核电荷数的和,则W(核电荷数为15)为P,非金属性P< Cl,故氢化物稳定性HCl> PH3;
(4)H、O两元素形成的原子个数比为2: 1的化合物H2O,属于分子晶体,H2O与Z元素形成的单质(Cl2)反应的化学方程式:Cl2+H2O ![]() HCl+HClO;
HCl+HClO;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(一)(1)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k正为________(以K和k逆表示)。若k正= 0.0027min-1,在t=40min时,v正=________min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)。
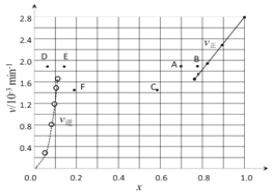
(二)常温下,将0.01 mol·L-1的Ba(OH)2溶液200mL和0.01 mol·L-1的NaHSO4溶液100mL混合,反应后溶液的pH值为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某![]() 、
、![]() 的混合溶液中加入少量的
的混合溶液中加入少量的![]() ,测得溶液中离子浓度的关系如图所示,下列说法正确的是
,测得溶液中离子浓度的关系如图所示,下列说法正确的是![]()
![]()
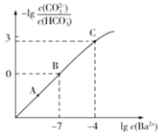
A.A,B,C三点对应溶液pH的大小顺序为:![]()
B.B点对应的溶液中存在:![]()
C.向C点溶液中通入![]() 可使C点溶液向B点溶液转化
可使C点溶液向B点溶液转化
D.该溶液中存在: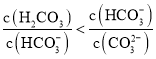
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
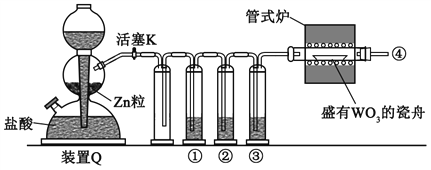
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热为 890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
B. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H = -38.6 kJ/mol
2NH3(g) △H = -38.6 kJ/mol
C. 稀盐酸和 稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol
D. 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(1)△H =+285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项关系中正确的是
A.0.1mol/LNa2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)=0.2mol/L
B.常温下pH=a的稀H2SO4与pH=b的氨水等体积混合后恰好完全反应,则a+b<14
C.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH)
D.pH相同的三种溶液①NH4Cl,②(NH4)2SO4,③NH4HSO4,c(NH4+)大小关系为①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 苯和氯气生成C6H6Cl6的反应是取代反应
B. 乙烯与溴水发生加成反应的产物是CH2CH2Br2
C. 等物质的量的甲烷与氯气反应的产物是CH3Cl
D. 硫酸作催化剂,CH3CO18OCH2CH3水解所得乙醇分子中有18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
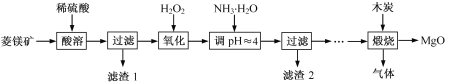
(1)MgCO3与稀硫酸反应的离子方程式为_______。
(2)加入H2O2氧化时,发生反应的化学方程式为_______。
(3)滤渣2 的成分是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族酯类化合物甲的分子式为C14H10O5,1 mol甲水解后只生成一种产物乙,其物质的量为2 mol,下列说法正确的是( )
A. 符合上述条件的甲共有3种B. 1 mol甲最多可以和3 mol NaOH反应
C. 乙不能和溴水发生反应D. 2 mol乙最多可以和1 mol Na2CO3反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com