
【题目】下列各组离子在溶液中可以大量共存的是( )
A. H+、SO32-、CO32-、SO42- B. Cu2+、Cl-、NO3-、CO32-
C. Mg2+、H+、SO42-、Cl- D. Mg2+、OH-、CO32-、H+
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】已知A是芳香族化合物,其分子式为C9H11Cl,利用A合成2-甲基苯乙酸,其合成路线如下:
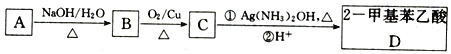
(1)A结构简式为_____________。
(2)A→B反应类型为_______;C中所含官能团的名称为______________。
(3)C→D第①步的化学方程式为____________。
(4)在NaOH醇溶液并加热的条件下,A转化为E,符合下列条件的E的同分异构体有___种,任写其中一种的结构简式____________。
i,苯环上仅有一个取代基;ii.能与溴水发生加成反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应A + 3B ![]() 2C + D 来说,下列反应速率中,最大的是
2C + D 来说,下列反应速率中,最大的是
A. v(A)=0.3mol/(L·min)B. v(B)=0.6mol/(L·min)
C. v(C)=0.5mol/(L·min)D. v(D)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知黑火药爆炸的反应是:S + 2 KNO3 + 3 C== K2S + 3 CO2↑ + N2↑ 。下列关于此反应的讨论正确的是
A. 若12克碳参加反应电子共转移12 molB. 该反应中还原剂只有碳
C. 该反应中氧化剂只有硝酸钾D. 反应产物中有两种共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了_________气体,继续滴加至液溴滴完。装置d的作用是_________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是_________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是_________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为_________,要进一步提纯,下列操作中必须的是____________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是_____________(填入正确选项前的字母):
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示内容填空:
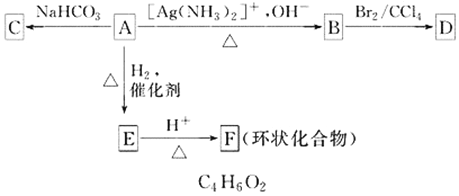
(1)化合物A含有的官能团为_______________________________________。
(2)1 mol A与2 mol H2反应生成1 mol E,其反应方程式为______________________。
(3)与A具有相同官能团的A的同分异构体的结构简式是____________。
(4)B在酸性条件下与Br2反应得到D,D的碳链不含支链,其结构简式是__________________________。
(5)F的结构简式是________。由E→F的反应类型是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 钢铁腐蚀的负极反应:Fe – 3e- === Fe3+
B. HCO![]() 的水解:HCO
的水解:HCO![]() +H2O
+H2O![]() CO32-+H3O+
CO32-+H3O+
C. 用惰性电极电解饱和食盐水: 2Cl–+2H2O![]() H2↑+ Cl2↑+2OH–
H2↑+ Cl2↑+2OH–
D. AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag+ + I- === AgI↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量氧化性较强的Cr2O72-,利用滴定原理测定Cr2O72-含量方法如下:
步骤Ⅰ:量取30.00 mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O72-+6I-+14H+ === 2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000 molL-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3 === 2NaI+Na2S4O6)
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
笫一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | a |
(1)步骤Ⅰ量取30.00 mL废水选择的仪器是_____。
(2)步骤Ⅲ中滴加的指示剂为_____。滴定达到终点的实验现象是____。
(3)步骤Ⅲ中a 的读数如图所示,则:
① a=_____。
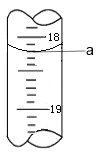
② Cr2O72-的含量为____gL-1。
(4)以下操作会造成废水中Cr2O72-含量测定值偏高的是_____。
A. 滴定终点读数时,俯视滴定管的刻度
B. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com