
【题目】工业废水中常含有一定量氧化性较强的Cr2O72-,利用滴定原理测定Cr2O72-含量方法如下:
步骤Ⅰ:量取30.00 mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O72-+6I-+14H+ === 2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000 molL-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3 === 2NaI+Na2S4O6)
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
笫一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | a |
(1)步骤Ⅰ量取30.00 mL废水选择的仪器是_____。
(2)步骤Ⅲ中滴加的指示剂为_____。滴定达到终点的实验现象是____。
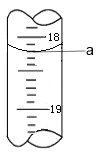
(3)步骤Ⅲ中a 的读数如图所示,则:
① a=_____。
② Cr2O72-的含量为____gL-1。
(4)以下操作会造成废水中Cr2O72-含量测定值偏高的是_____。
A. 滴定终点读数时,俯视滴定管的刻度
B. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗
【答案】 酸式滴定管 淀粉溶液 溶液刚好从蓝色变为无色,且30s内不变色 18.20 2.16 CD
【解析】根据实验目的,含有一定量的Cr2O72-工业废水,
步骤I:取30.00 mL废水,加入适量稀硫酸酸化,提供酸性环境;
步骤Ⅱ:因为Cr2O72-具有氧化性,加入过量的碘化钾溶液,把Cr2O72-还原成三价铬,而碘离子被氧化成碘单质;
步骤III:用0.1000 molL-1Na2S2O3溶液滴定生成的碘单质,通过消耗的Na2S2O3溶液量来计算碘单质的量,再根据碘单质的量回头计算Cr2O72-的量,从而达到实验目的。
详解:(1)根据信息,Cr2O72-氧化性较强,量取废水应用酸式滴定管,因此,本题正确答案是:酸式滴定管;
(2)滴定碘单质应选用淀粉溶液作指示剂;滴定达到终点时碘单质刚好被消耗,所以溶液的颜色由蓝色变为无色,且在半分钟内不变色,
因此,本题正确答案是:淀粉溶液;溶液由蓝色变为无色,且在半分钟内不变色;
(3)① 根据图示,滴定管“0”刻度在上,且精确到0.01mL,a值为18.20;
②从表格数据可知,三次实验消耗0.1000 molL-1Na2S2O3标准溶液的体积平均值为18.00mL,
根据Cr2O72-+6I-+14H+ === 2Cr3++3I2+7H2O和I2+2Na2S2O3 === 2NaI+Na2S4O6
Cr2O72-~3I2~6Na2S2O3,
n(Cr2O72-)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() 0.1000mol/L×18.00×10-3L=3×10-4mol
0.1000mol/L×18.00×10-3L=3×10-4mol
Cr2O72-的含量为:![]() = 2.16gL-1
= 2.16gL-1
(4)根据Cr2O72-+6I-+14H+ === 2Cr3++3I2+7H2O和I2+2Na2S2O3 === 2NaI+Na2S4O6,
则c(待测)偏高,Cr2O72-含量就偏高;
A.滴定终点读数时,俯视滴定管的刻度,造成V(标准)偏小,根据c(待测)=![]() 分析,测定c(待测)偏低,故A错误;
分析,测定c(待测)偏低,故A错误;
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗,对V(标准)无影响,根据c(待测)=![]() 分析,测定c(待测)无影响,故B错误;
分析,测定c(待测)无影响,故B错误;
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(标准)偏大,根据c(待测)=![]() 分析,测定c(待测)偏高,所以C选项是正确的;
分析,测定c(待测)偏高,所以C选项是正确的;
D.未用标准液润洗碱式滴定管,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)![]() 分析,测定c(待测)偏高,所以D选项是正确的;
分析,测定c(待测)偏高,所以D选项是正确的;
因此,本题正确答案是:CD。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中可以大量共存的是( )
A. H+、SO32-、CO32-、SO42- B. Cu2+、Cl-、NO3-、CO32-
C. Mg2+、H+、SO42-、Cl- D. Mg2+、OH-、CO32-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 在0.1 molL-1Na2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 | CO32-水解是吸热反应 |
B | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 | 酸性A比B强 |
C | 常温下,用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH约为10;0.1 molL-1 NaHSO3溶液的pH约为5 | HSO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗制的氧化铜粉末(含杂质Fe和SiO2)来制取无水CuCl2的工艺流程如图所示:
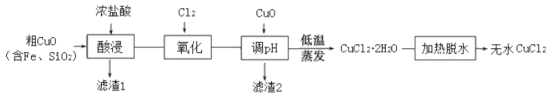
(1)“酸浸”时发生的复分解反应化学方程式为:____。为加快酸浸速率可以采取的措施是:____(任举一条)。
(2)“氧化”时发生的离子方程式为:_____。
(3)下表列出了相关金属离子生成氢氧化物沉淀的pH。“调pH”时应控制溶液pH范围为_____。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 5 | 3. 7 |
Cu2+ | 4.2 | 6. 4 |
Fe2+ | 6.5 | 9.7 |
当pH=4时,溶液中c(Fe3+)=____。已知:Ksp[Fe(OH)3]=2.6×10―39
(4)“加热脱水”需要提供的条件为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染问题日益引起全民关注。
(1)汽车尾气中存在大量的CO、NO、NO2和碳氢化合物,可采用铂等贵金属作为催化剂,使CO和NO转化为无毒的气体,请写出其化学方程式____________________________
(2)科研工作者研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO3)2。

①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为____________________________、 ______________________________
②CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为___________________________
③Ca(NO3)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO3)2的化学方程式___________________________
(3)还可用NaClO2溶液(溶液呈碱性)作为吸收剂,对含有SO2和NOX的燃煤烟气进行脱硫、脱硝。(已知:酸性条件下,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,能氧化SO2或NOX)在鼓泡反应期中通入含SO2和NO的烟气,反应温度为323K,NaClO2溶液的浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。

①写出NaClO2溶液脱硝过程中主要反应的离子方程式_____________________________。增加压强,NO的转化率_______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“提高”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是
A.医用消毒酒精中乙醇的浓度(体积分数)为95%
B.硅胶可用作瓶装药品、袋装食品的干燥剂
C.化石燃料完全燃烧不会造成大气污染
D.铁比铜金属性强,FeCl3腐蚀Cu刻制印刷电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):
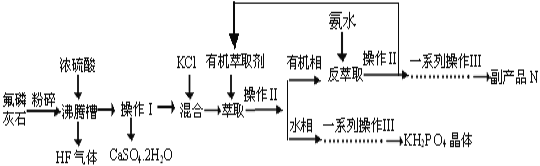
已知萃取的主要反应原理:KCl+H3PO4![]() KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)流程中将氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材质的沸腾槽的主要原因是___________________(用化学方程式表示)。
(3)副产品N的化学式是____________;在得到KH2PO4晶体的一系列操作Ⅲ,其主要包括______________________________、过滤、洗涤、干燥等。
(4)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,则理论上可生产KH2PO4的质量为_______kg。
(5)电解法制备KH2PO4的装置如图所示.该电解装置中,a 区属于_______区(填“阳极”或“阴极”),阴极区的电极反应式是______________________________________。

(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
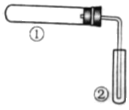
①中实验 | ②中现象 | |
A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在75℃左右,用HgS04做催化剂,乙炔可水化为乙醛,但HgS04遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、Hg0粉末五种物质制乙醛,装置如下图所示,请回答下列问题:

(1)实验开始时,仪器A中盛放电石,B中应装__________,其作用是__________。
(2)仪器D中盛放水,其作用是__________。
(3)蒸馏烧瓶F中应加入Hg0和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括Hg0在内的各试剂的名称____________________。
(4)装置图中,加热F的方法叫__________,所选用温度计G的量程表示正确的是________(填字母)。
A.0℃~50℃ B.0℃~100℃ C.0℃~200℃ D.50℃~100℃ E.0℃~360℃
(5)检验乙醛已制出的操作及现象是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com