
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 在0.1 molL-1Na2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 | CO32-水解是吸热反应 |
B | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 | 酸性A比B强 |
C | 常温下,用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH约为10;0.1 molL-1 NaHSO3溶液的pH约为5 | HSO |
A. A B. B C. C D. D
【答案】AD
【解析】A.滴有酚酞的Na2CO3溶液,加热促进碳酸根离子的水解,则颜色加深;
B.等体积等pH值的酸,酸的浓度越大,酸性越弱;
C.难溶电解质的溶解平衡中,溶度积大的电解质能向溶度积小的电解质转化,注意浓度的大小问题;
D.SO![]() 结合H+为一级水解,HSO3-结合H+为二级水解,HSO
结合H+为一级水解,HSO3-结合H+为二级水解,HSO![]() 结合H+的能力比SO32-的弱。
结合H+的能力比SO32-的弱。
详解:A.滴有酚酞的溶液Na2CO3显示红色,是因为碳酸钠溶液中的碳酸根离子水解溶液呈碱性,其中碳酸根离子水解程度受温度的影响,微热,溶液颜色逐渐变深,说明温度高,水解程度大,碱性增强,所以盐类水解是吸热反应,所以A选项是正确的;
B.当体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA的物质的量大于HB的物质的量,溶液的体积相等,HA的物质的量浓度大于HB的,所以说明酸性:HA<HB,故B错误;
C.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,部分BaSO4因饱和Na2CO3溶液中高浓CO32-转化BaCO3,但是Ksp(BaCO3)>Ksp(BaSO4),故C错误;
D.SO![]() 结合H+为一级水解,HSO3-结合H+为二级水解,HSO
结合H+为一级水解,HSO3-结合H+为二级水解,HSO![]() 结合H+的能力比SO32-的弱,故D正确;
结合H+的能力比SO32-的弱,故D正确;
所以AD选项是正确的。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对反应A + 3B ![]() 2C + D 来说,下列反应速率中,最大的是
2C + D 来说,下列反应速率中,最大的是
A. v(A)=0.3mol/(L·min)B. v(B)=0.6mol/(L·min)
C. v(C)=0.5mol/(L·min)D. v(D)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示内容填空:
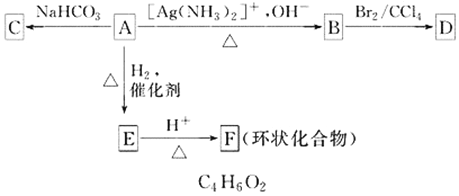
(1)化合物A含有的官能团为_______________________________________。
(2)1 mol A与2 mol H2反应生成1 mol E,其反应方程式为______________________。
(3)与A具有相同官能团的A的同分异构体的结构简式是____________。
(4)B在酸性条件下与Br2反应得到D,D的碳链不含支链,其结构简式是__________________________。
(5)F的结构简式是________。由E→F的反应类型是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 钢铁腐蚀的负极反应:Fe – 3e- === Fe3+
B. HCO![]() 的水解:HCO
的水解:HCO![]() +H2O
+H2O![]() CO32-+H3O+
CO32-+H3O+
C. 用惰性电极电解饱和食盐水: 2Cl–+2H2O![]() H2↑+ Cl2↑+2OH–
H2↑+ Cl2↑+2OH–
D. AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag+ + I- === AgI↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. 加水稀释可以使溶液由c点变到d点
B. 此温度时,Ksp(BaSO4)=1.1×10-10
C. b点有BaSO4沉淀析出
D. a点对应的Ksp等于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1.0L的恒容密闭容器中,充入一定量的A和B分别发生下列反应:3A(g)+B(g)![]() 2C(g)+D(g)+E(s),下列说法正确的是
2C(g)+D(g)+E(s),下列说法正确的是
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
A | B | A | B | ||
容器Ⅰ | 300 | 3 | 1 | 0.8 | |
容器Ⅱ | 300 | 6 | 2 | ||
容器Ⅲ | 240 | 3 | 1 | 0.4 | |
A. 该反应正反应为吸热反应
B. 反应达到平衡后加入2molE,A的转化率减小
C. 容器Ⅱ达到平衡时B的转化率比容器I大
D. 240℃ 时,该反应的平衡常数K=1.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A. 在沸腾炉中进行的反应为:4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
B. 工业上制硫酸与硝酸都用到同一工艺设备:吸收塔
C. 硫酸工业、硝酸工业都需要对工业尾气进行处理
D. 工业上制备硫酸和制硝酸涉及的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量氧化性较强的Cr2O72-,利用滴定原理测定Cr2O72-含量方法如下:
步骤Ⅰ:量取30.00 mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O72-+6I-+14H+ === 2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000 molL-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3 === 2NaI+Na2S4O6)
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
笫一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | a |
(1)步骤Ⅰ量取30.00 mL废水选择的仪器是_____。
(2)步骤Ⅲ中滴加的指示剂为_____。滴定达到终点的实验现象是____。
(3)步骤Ⅲ中a 的读数如图所示,则:
① a=_____。
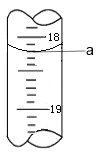
② Cr2O72-的含量为____gL-1。
(4)以下操作会造成废水中Cr2O72-含量测定值偏高的是_____。
A. 滴定终点读数时,俯视滴定管的刻度
B. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,X既能与Y反应又能与Z反应的是
Y | X | Z | |
① | H2O(g) | Fe | ZnSO4溶液 |
② | KOH溶液 | Al | 稀硫酸 |
③ | Si | Cl2 | H2 |
④ | 酸性高锰酸钾溶液 | Fe2+(aq) | 漂白液 |
A.①③B.①④C.②③④D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com