
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是

A. 加水稀释可以使溶液由c点变到d点
B. 此温度时,Ksp(BaSO4)=1.1×10-10
C. b点有BaSO4沉淀析出
D. a点对应的Ksp等于c点对应的Ksp
【答案】A
【解析】分析:该图中的是平衡曲线,线上的任意点都是平衡状态,b和d不是平衡状态,
A、加入蒸馏水,c(SO42-)、c(Ba2+)均减小;
B、图中a点,c(SO42-)=5.5×10-6mol/L,c(Ba2+)=2×10-5mol/L,所以Ksp(BaSO4)=c(SO42-)·c(Ba2+)=5.5×10-6×2×10-5=1.1×10-10;
C、b点表示QC>Ksp,溶液过饱和;
D、Ksp与温度有关,a和c的Ksp相等。
详解:A、加入蒸馏水,c(SO42-)、c(Ba2+)均减小,不可能出现c(SO42-)不变,而c(Ba2+)减小的情况,故A错误;
B.图中a点,c(SO42-)=5.5×10-6mol/L,c(Ba2+)=2×10-5mol/L,所以Ksp(BaSO4)=c(SO42-)·c(Ba2+)=5.5×10-6×2×10-5=1.1×10-10,故B正确;
C、b点表示QC>Ksp,溶液过饱和,会有沉淀析出,所以C选项是正确的;
D、Ksp是溶度积常数,只随着温度的改变而改变,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故D正确;
所以本题答案选A。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,下列说法错误的是
A.可在水中加入铁盐或明矾来净化水
B.可在豆浆中加入石膏制作豆腐,利用的是胶体的聚沉
C.可用二氧化硅作太阳能电池的材料,晶体硅做光导纤维
D.可用氢氧化铝或小苏打治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4①
R—OH+HBr![]() R—Br+H2O②
R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
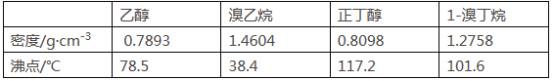
请回答下列问题:
(1)溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性________(填“大于”、“等于”或“小于”)相应的醇,其原因是_________。
(3)将1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
a.NaI b.NaOH c.NaHSO3d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于_______;但在制备1溴丁烷时却不能边反应边蒸出产物,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各组离子一定能大量共存的是( )
A. 使甲基橙呈红色的溶液中:Na+、AlO2-、NO3—、Fe2+
B. 0.1 molL-1HCl溶液:Ba2+、K+、CH3COO-、NO3—
C. 0.1 molL-1 CO32-的溶液:Na+、Fe3+、NO![]() 、SCN-
、SCN-
D. Kw/c(H+)=0.1 molL-1的溶液:Na+、K+、SO32-、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 在0.1 molL-1Na2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 | CO32-水解是吸热反应 |
B | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 | 酸性A比B强 |
C | 常温下,用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH约为10;0.1 molL-1 NaHSO3溶液的pH约为5 | HSO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈;____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____。
(3)用电子式表示次氯酸形成过程______。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律

(1)仪器D的名称为_____,其作用为___。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液____(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,用离子方程式表示该尾气吸收原理______。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_____(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有____的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染问题日益引起全民关注。
(1)汽车尾气中存在大量的CO、NO、NO2和碳氢化合物,可采用铂等贵金属作为催化剂,使CO和NO转化为无毒的气体,请写出其化学方程式____________________________
(2)科研工作者研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO3)2。

①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为____________________________、 ______________________________
②CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为___________________________
③Ca(NO3)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO3)2的化学方程式___________________________
(3)还可用NaClO2溶液(溶液呈碱性)作为吸收剂,对含有SO2和NOX的燃煤烟气进行脱硫、脱硝。(已知:酸性条件下,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,能氧化SO2或NOX)在鼓泡反应期中通入含SO2和NO的烟气,反应温度为323K,NaClO2溶液的浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。

①写出NaClO2溶液脱硝过程中主要反应的离子方程式_____________________________。增加压强,NO的转化率_______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“提高”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素,它们的核电荷数均小于18,且原子序数逐渐增大。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。11.5g A单质恰好与100mL 5mol/L的盐酸完全反应,反应后溶液呈中性。D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。请回答下列问题:
(1)写出D的元素符号______,E的最高价氧化物的水化物的化学式__________。
(2)画出B元素的离子结构示意图__________________。
(3)若构成F元素的一种原子的质量数为35,写出其原子符号________。
(4)A与F反应的离子方程式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com