
【题目】一定温度下,在三个体积均为1.0L的恒容密闭容器中,充入一定量的A和B分别发生下列反应:3A(g)+B(g)![]() 2C(g)+D(g)+E(s),下列说法正确的是
2C(g)+D(g)+E(s),下列说法正确的是
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
A | B | A | B | ||
容器Ⅰ | 300 | 3 | 1 | 0.8 | |
容器Ⅱ | 300 | 6 | 2 | ||
容器Ⅲ | 240 | 3 | 1 | 0.4 | |
A. 该反应正反应为吸热反应
B. 反应达到平衡后加入2molE,A的转化率减小
C. 容器Ⅱ达到平衡时B的转化率比容器I大
D. 240℃ 时,该反应的平衡常数K=1.25
【答案】CD
【解析】容器Ⅰ、容器Ⅱ 在相同温度下反应,容器Ⅱ 浓度较大,压强较大,由方程式可以知道增大压强平衡正向移动,容器II反应温度较低,达到平衡时B的物质的量比容器I少,说明降低温度,平衡正向移动,则正反应为放热反应,以此解答该题。
详解:A.容器I 和容器III 比较可以知道,起始量相同,平衡量Ⅰ 中B的物质的量大于容器III中B的物质的量,说明温度越低平衡正向进行,正反应为放热反应,该反应正反应为放热反应,故A错误;
B.反应达到平衡后加入2molE,E为固体,改变E的量不影响平衡,A的转化率不变,故B错误;
C.容器Ⅰ、容器II在相同温度下反应,容器II浓度较大,压强较大,由方程式可以知道增大压强平衡正向移动,所以容器II达到平衡时B的转化率比容器I大,故C正确;
D.由表格中数据可以知道,
3A(g)+B(g)![]() 2C(g)+D(g)+E(s)
2C(g)+D(g)+E(s)
起始量(mol/L) 3 100
变化量(mol/L)1.8 0.6 1.2 0.6
平衡量(mol/L)1.20.4 1.2 0.6
K=![]() =1.25,所以D选项是正确的;
=1.25,所以D选项是正确的;
所以CD选项是正确的。


科目:高中化学 来源: 题型:
【题目】向仅含 Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如下图所示。下列说 法中正确的是
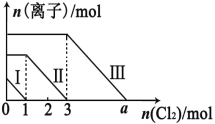
A. 线段Ⅲ代表 Fe2+的变化情况
B. 线段Ⅰ代表 Br -的变化情况
C. 原混合溶液中 n(FeBr2)=4mol
D. a 数值等于 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 | A | B | C | D |
物质 | CO2 | MgCl2 | HCl | NaOH |
所含化学键类型 | 共价键 | 离子键、共价键 | 离子键 | 离子键、共价键 |
所属化合物类型 | 共价化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
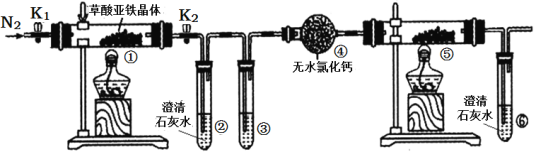
A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 在0.1 molL-1Na2CO3溶液中,滴加2滴酚酞显浅红色,微热,红色加深 | CO32-水解是吸热反应 |
B | 等体积、pH=3的两种酸HA和HB分别与足量的Zn反应,酸HA放出的氢气多 | 酸性A比B强 |
C | 常温下,用饱和Na2CO3溶液可将BaSO4部分转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH约为10;0.1 molL-1 NaHSO3溶液的pH约为5 | HSO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1molDAx与足量的A2C反应生成44.8L(标准状况)G气体。A、B的单质依次为G、T,在密闭容器中充入一定量的G、T,一定条件下发生反应G+T→W(未配平),测得各物质的浓度如表所示。
物质 | T | G | W |
10min时,c/(mol/L) | 0.5 | 0.8 | 0.2 |
20min时,c/(mol/L) | 0.3 | 0.2 | 0.6 |
回答下列问题:
(1)A、B、C能组成既含离子键又含共价键的化合物,该化合物的化学式为_________。
(2)B、C、D、E的简单离子中,离子半径由大到小排序为__________。(用离子符号表示)
(3)J、L是由A、B、C、E四种元素组成的两种常见酸式盐,J、L混合可产生有刺激性气味的气体,写出这两种溶液发生反应的离子方程式_______;J、L中能使酸性高锰酸钾溶液退色的是_______(填化学式)。
(4)B2A4-C2碱性燃料电池放电效率高。该电池放电时生成B2和A2C,正极反应式为_____;电池工作一段时间后,电解质溶液的pH_____(填“增大”“减小”或“不变”)。
(5)由A、B、C、D四种元素组成的单质、化合物在一定条件下的转化关系(部分条件和产物已省略)如图所示,已知M耐高温。
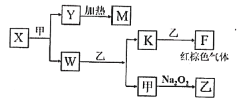
①X的电子式为______;W的结构式为________。
②已知W与乙反应生成K和甲是某重要化工生产步骤之一,提高其反应速率的方法除增大反应物浓度、增大压强外,还有______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗制的氧化铜粉末(含杂质Fe和SiO2)来制取无水CuCl2的工艺流程如图所示:
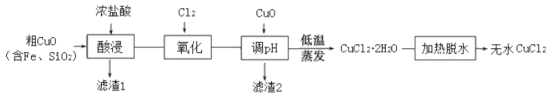
(1)“酸浸”时发生的复分解反应化学方程式为:____。为加快酸浸速率可以采取的措施是:____(任举一条)。
(2)“氧化”时发生的离子方程式为:_____。
(3)下表列出了相关金属离子生成氢氧化物沉淀的pH。“调pH”时应控制溶液pH范围为_____。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 5 | 3. 7 |
Cu2+ | 4.2 | 6. 4 |
Fe2+ | 6.5 | 9.7 |
当pH=4时,溶液中c(Fe3+)=____。已知:Ksp[Fe(OH)3]=2.6×10―39
(4)“加热脱水”需要提供的条件为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是
A.医用消毒酒精中乙醇的浓度(体积分数)为95%
B.硅胶可用作瓶装药品、袋装食品的干燥剂
C.化石燃料完全燃烧不会造成大气污染
D.铁比铜金属性强,FeCl3腐蚀Cu刻制印刷电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列过程的ΔH和ΔS,用“> 0”或“< 0”来表示
化学方程式 | ΔH | ΔS |
H2O(l)→H2O(g) | _________ | ________ |
CaCO3(s) == CaO (s) + CO2(g) | _______ | _______ |
NaOH(s)== Na+(aq)+OH-(aq) | _______ | ________ |
N2(g)+3H2(g) | ______ | ________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com