
【题目】电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图所示,下列说法正确的是
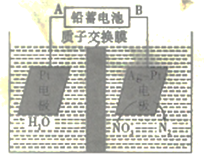
A.电源正极为B
B.H+由右侧通过交换膜移动到左侧
C.该电解池的阴极反应式为2NO3-+12H+ +10e-=N2↑+6H2O
D.标况下,若有2. 24LN2生成,理论上铅蓄电池中有20.7克Pb消耗
科目:高中化学 来源: 题型:
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
汽车的排气管上安装“催化转化器”,发生反应①:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-746.5 kJ·mol-1。
2CO2(g)+N2(g) △H=-746.5 kJ·mol-1。
(1)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如图。
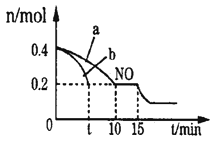
①图中a,b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__。(填“a”或“b”)
②T℃时,该反应的化学平衡常数K=__;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将__移动。(填“向左”、“向右”或“不”)
③15min时,若改变外界反应条件,导致n(NO)发生图中所示变化,则改变的条件可能是___(任答一条即可)。
④又已知:反应②N2(g)+O2(g)![]() 2NO(g) △H2=+180.5 kJ·mol-1,则CO的燃烧热△H=__。
2NO(g) △H2=+180.5 kJ·mol-1,则CO的燃烧热△H=__。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应①,如图为平衡时NO的体积分数与温度、压强的关系。

①温度:T1__T2(填“<”或“>”)。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝原理,其脱硝率(脱硝率即NO的转化率)与温度、负载率(分子筛中催化剂的质量分数)的关系如图所示。
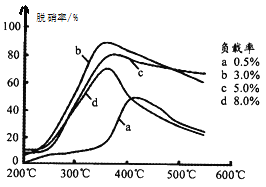
为达到最佳脱硝效果,应采取的条件是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于各图的说法(其中①③④中均为情性电极)正确的是( )
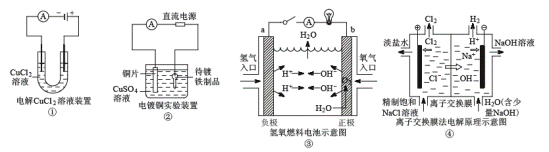
A.①装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示。已知:a电扱的反应式为O2+4H++4e-=2H2O,下列说法不正确的是

A. b电极的反应式为CH3OCH3+3H2O-12e-==2CO2↑+12H+
B. 试剂A为饱和食盐水,试刑B为NaOH稀溶液
C. 阳极生成1 mol气体时,有1mol离子通过离子交换膜
D. 阴极生成1 mol气体时,理论上导线中流过2 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性, Z元素无正价,且基态原子有2个未成对电子,基态W原子价层电子排布式为nsn-1npn-1 ,X与W为同主族元素。基态R原子M能层全充满且核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子的核外电子排布式为____________________。R单质晶体晶胞的堆积方式_______________,晶胞的空间利用率为___________________。
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为__________ (填“元素符号”,下同)
(3)YF3分子中Y的杂化类型为______________。该分子的空间构型为_________________。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___________________。
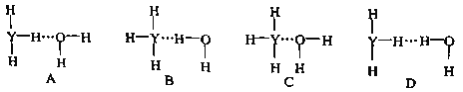
(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是_________cm (NA表示阿伏伽德罗常数的值)。
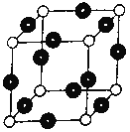
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与足量的NaOH溶液共热后,再通入CO2
B.溶液加热,通入足量的HCl
C.与稀H2SO4共热后,加入足量的Na2CO3
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g) eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度(T)和不同压强(p)的条件下随时间(t)的变化关系如图所示,下列叙述正确的是
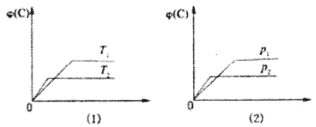
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.达到平衡后,增加A的质量最有利于化学平衡向正反应方向移动
C.化学方程式中,n<e+f
D.当平衡后,若温度升高,化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料在国民经济建设等领域具有重要应用,镁、铬、镍、铜是几种重要的金属元素。请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为__,结构中有__种不同形状的电子云。
(2)镁属于元素周期表中的__区元素,MgO的熔点高于CuO的原因是__。
(3)氯化铬酰(CrO2Cl2)熔点:-96.5℃,沸点:117℃,能与CS2等互溶,则固态CrO2Cl2属于__晶体。已知NO2+与CS2互为等电子体,则1molNO2+中含有π键数目为__。
(4)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为__,[Cu(CH3C≡N)4]+中所有元素的电负性由大到小的顺序是__,BF4-的空间构型为__。
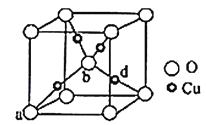
(5)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为__cm(列出计算式即可)。
),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为__cm(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com