
【题目】可逆反应mA(s)+nB(g) eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度(T)和不同压强(p)的条件下随时间(t)的变化关系如图所示,下列叙述正确的是
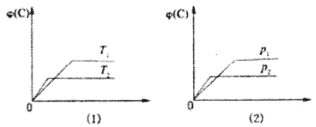
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.达到平衡后,增加A的质量最有利于化学平衡向正反应方向移动
C.化学方程式中,n<e+f
D.当平衡后,若温度升高,化学平衡向正反应方向移动
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
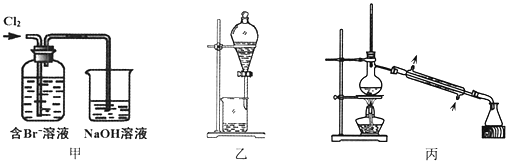
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图所示,下列说法正确的是
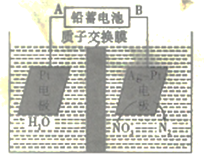
A.电源正极为B
B.H+由右侧通过交换膜移动到左侧
C.该电解池的阴极反应式为2NO3-+12H+ +10e-=N2↑+6H2O
D.标况下,若有2. 24LN2生成,理论上铅蓄电池中有20.7克Pb消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒及其化合物在特种钢材的生产、高效催化剂的制备及航天工业中用途广泛。工业上以富钒炉渣(主要成分为V2O5,含少量Fe2O3和FeO等杂质)为原料提取五氧化二钒的工艺流程如图所示:
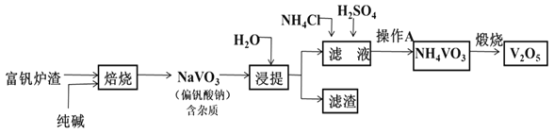
(1)五氧化二钒中钒的化合价为__。
(2)焙烧炉中发生的主要反应化学方程式为__;也可用氯化钠和氧气代替纯碱进行焙烧反应,写出对应的化学反应方程式__,该方法的缺点是:__。
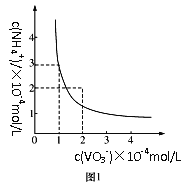
(3)已知NH4VO3难溶于水,在水中的Ksp曲线如图1所示,则在实验中进行操作A所需要的玻璃仪器有__;向10mL含NaVO30.2mol/L的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO3-沉淀完全,则NH4Cl溶液的最小浓度为__。(当溶液中某离子浓度小于1×10-5mol/L时,认为该离子沉淀完全)
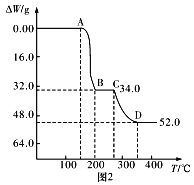
(4)为研究煅烧过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,焙烧过程中减少的质量随温度变化的曲线如图2所示,则C点所得物质化学式为__,写出CD段发生反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;制取Cl2并通入滤液氧化Br-,用苯萃取分液。其中部分操作的装置如图所示,下列叙述正确的是( )
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌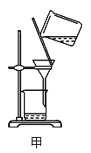
B.用装置乙在空气中高温灼烧Ag2S制取Ag
C.用装置丙制备用于氧化滤液中Br-的Cl2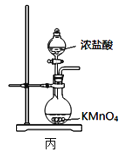
D.用装置丁分液时,先放出水相再放出有机相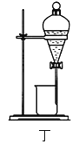
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是
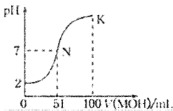
A.HA为一元弱酸
B.MOH为一元强碱
C.N点水的电离程度小于K点水的电离程度
D.K点时,则有c(MOH)+c(OH-)-c(H+)=0.005 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为测定未知浓度的硫酸溶液,实验如下:用1.00 mL待测硫酸配制100 mL稀硫酸。以0.12 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00 mL,滴定终止时消耗NaOH溶液15.00 mL。该学生用标准0.12 mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A.用蒸馏水洗干净碱式滴定管;
B.检查碱式滴定管是否漏液;
C.用移液管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂;
D.将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下,并记录读数;
E.用标准的NaOH溶液润洗碱式滴定管;
F.按上述操作重复两至三次;
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
(1)滴定操作的正确顺序是(用序号填写)__________;该滴定操作中选用的指示剂是酚酞,则在G操作中如何确定滴定终点?____________。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果________ (填“偏小”、“偏大”或“不变”)
(3)滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则结果会导致测得的稀H2SO4溶液浓度测定值__________(选填“偏大”“偏小”或“无影响”,下同);若滴定前仰视碱式滴定管刻度线,滴定终了俯视刻度线,会使滴定结果__________;
(4)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度__________mol·L-1
(5)写出用稀硫酸中和Ba(OH)2溶液时的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下列装置进行浓硫酸和铜反应并验证二氧化硫的性质。
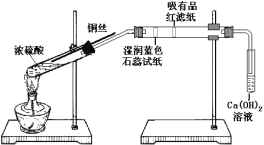
按如图实验装置连接仪器和放置药品。加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出。实验结束后会看到两个试管的液体底部均有少量的白色固体。下列对该实验的现象分析或推断正确的是( )
A.湿润的蓝色石蕊试纸先变红后褪色
B.左边试管出现的白色固体是由于浓硫酸的脱水性所致
C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应
D.本实验体现出了二氧化硫的酸性、漂白性和弱氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为___。
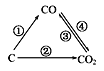
(2)一定条件下,在密闭容器中发生反应CO2(g)+C(s)![]() 2CO(g)达到平衡,能使平衡向正反应方向移动的有__(填字母)。
2CO(g)达到平衡,能使平衡向正反应方向移动的有__(填字母)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量Ar
C.增加碳的用量
D.保持其他条件不变,升高温度
(3)根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com