
【题目】某同学利用下列装置进行浓硫酸和铜反应并验证二氧化硫的性质。
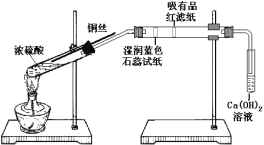
按如图实验装置连接仪器和放置药品。加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出。实验结束后会看到两个试管的液体底部均有少量的白色固体。下列对该实验的现象分析或推断正确的是( )
A.湿润的蓝色石蕊试纸先变红后褪色
B.左边试管出现的白色固体是由于浓硫酸的脱水性所致
C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应
D.本实验体现出了二氧化硫的酸性、漂白性和弱氧化性
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示。已知:a电扱的反应式为O2+4H++4e-=2H2O,下列说法不正确的是

A. b电极的反应式为CH3OCH3+3H2O-12e-==2CO2↑+12H+
B. 试剂A为饱和食盐水,试刑B为NaOH稀溶液
C. 阳极生成1 mol气体时,有1mol离子通过离子交换膜
D. 阴极生成1 mol气体时,理论上导线中流过2 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g) eC(g)+fD(g)反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度(T)和不同压强(p)的条件下随时间(t)的变化关系如图所示,下列叙述正确的是
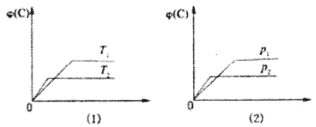
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.达到平衡后,增加A的质量最有利于化学平衡向正反应方向移动
C.化学方程式中,n<e+f
D.当平衡后,若温度升高,化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H++OH-,向右移动且溶液呈酸性的是 ( )
H++OH-,向右移动且溶液呈酸性的是 ( )
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液
D.将水加热到100℃,使pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列有关叙述正确的是( )
A.2.24LCO2与足量Na2O2反应,转移的电子数目为0.1NA
B.1molCH4与足量的C12在光照下反应生成的CH3C1分子数为NA
C.已知反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-akJ/mol,当生成NA个SO3分子时,反应放出的热量小于0.5akJ
2SO3(g) ΔH=-akJ/mol,当生成NA个SO3分子时,反应放出的热量小于0.5akJ
D.在1L0.1mol/L碳酸钠溶液中,阴离子总数大于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]·3H2O)易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:
Fe +H2SO4 = FeSO4 +H2↑
FeSO4 + H2C2O4 + 2H2O =FeC2O4·2H2O↓+ H2SO4
2FeC2O4·2H2O + H2O2 + H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O
回答下列问题:
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是________(选填序号);
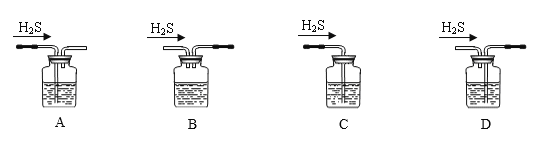
(2)在将Fe2+氧化的过程中,需控制溶液温度不高于40℃,理由是________;
(3)得到K3[Fe(C2O4)3]溶液后,再想获得其晶体,常加入_____溶剂(填编号)
a. 冰水 b. 无水乙醇 c. 四氯化碳
(4)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④步,⑥计算。
步骤⑤也被称做________操作,其目的是____________________________;
(5)重量分析法测定时,步骤③未在干燥器中进行,那么测得的晶体中所含结晶水含量________(填“偏高”、“偏低”或“无影响”);
(6)三草酸合铁(Ⅲ)酸钾晶体用重量分析法测定时,2.810g的晶体经操作最终获得了2.480g无水物,则此次测定的相对误差为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料在国民经济建设等领域具有重要应用,镁、铬、镍、铜是几种重要的金属元素。请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为__,结构中有__种不同形状的电子云。
(2)镁属于元素周期表中的__区元素,MgO的熔点高于CuO的原因是__。
(3)氯化铬酰(CrO2Cl2)熔点:-96.5℃,沸点:117℃,能与CS2等互溶,则固态CrO2Cl2属于__晶体。已知NO2+与CS2互为等电子体,则1molNO2+中含有π键数目为__。
(4)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为__,[Cu(CH3C≡N)4]+中所有元素的电负性由大到小的顺序是__,BF4-的空间构型为__。
(5)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为__cm(列出计算式即可)。
),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为__cm(列出计算式即可)。
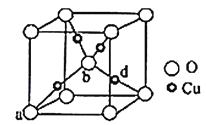
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁粉和铝粉的混合物与足量很稀的硝酸充分反应,无气体放出。在反应结束后的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是( )
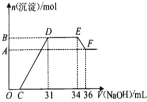
A.溶液中n(NH4+)=0.012mol
B.混合物中铝粉与铁粉物质的量的比为1:2
C.测定F点沉淀的质量,步骤是:过滤、洗涤、低温烘干、称量
D.铝与该浓度硝酸反应的离子方程式为:8Al+30H++3NO3-=8Al3++3NH4++9H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、101 kPa的条件下,相同质量的CH4和A气体的体积之比是15:8,则A的摩尔质量为___。
(2)两个相同容积的密闭容器X、Y,在25℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4:11,则A的摩尔质量为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com