
����Ŀ����������Ϊ�����л��
�ټױ� ��1��3������ϩ ��ֱ������ ��ֲ����
��գ�
��1������ʹ��ˮ������ѧ�仯��ɫ��Ҳ��ʹ���Ը��������ɫ������____�����ţ���
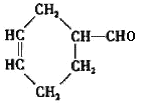
��2���ܺ�����������Һ��Ӧ����______�����ţ���д���÷�Ӧ����֮һ�����������Ļ�ѧ����ʽ______��
��3����֪������ϩ����ͨ��1��3������ϩ����ϩ���������ӳɷ�Ӧ�õ���
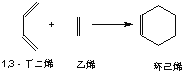
ʵ��֤�������з�Ӧ�У���Ӧ����ӵĻ���˫���Ȼ���˫�������ױ�������
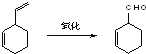
�ֽ���1��3������ϩΪ�л�ԭ�ϣ����Լ���ѡ��������;���ϳɼ������飺
��a��д���ṹ��ʽ��A______��B_____
��b������������������黥Ϊͬϵ�����_______
��c��1mol A��1mol HBr�ӳɿ��Եõ�_____�ֲ��
���𰸡��� �� 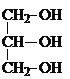 +3HNO3��
+3HNO3��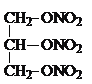 +3H2O
+3H2O 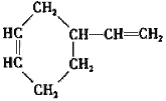
 A 4
A 4
��������
(1)ֲ���������������ʣ�����ʹ��ˮ������ѧ�仯��ɫ��Ҳ��ʹ���Ը��������ɫ��������̼̼�����ͼ����ݴ˷����жϣ�
(2)��������NaOH��Ӧ�����ܹ���NaOH��Һ��ˮ�⣬�ݴ˷������
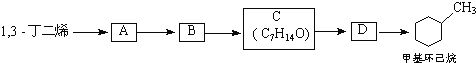
(3)����̼ԭ����Ŀ��֪����Ӧ��Ϊ1��3-����ϩ��CH2=CH-CH3������Ϣ��Ӧ����A����AΪ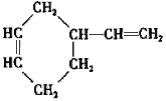 ��A������Ϣ��ķ�Ӧ����B����BΪ
��A������Ϣ��ķ�Ӧ����B����BΪ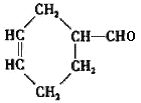 �����C�ķ���ʽ��֪��B����������ȫ�ӳɷ�Ӧ����C��CΪ
�����C�ķ���ʽ��֪��B����������ȫ�ӳɷ�Ӧ����C��CΪ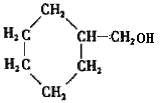 ��C������ȥ��Ӧ����D��DΪ
��C������ȥ��Ӧ����D��DΪ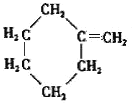 ��D�����ӳɷ�Ӧ���ɼ������飬�ݴ˷������
��D�����ӳɷ�Ӧ���ɼ������飬�ݴ˷������
(1)ֲ���������������ʣ����������ױ���ֱ�������в�����̼̼˫��������ʹ��ˮ������ѧ��Ӧ��ɫ��1��3-����ϩ�к���̼̼˫�����ܹ�����ˮ�����ӳɷ�Ӧ���ܹ������Ը������������ʹ���������Һ��ɫ���ʴ�Ϊ���ڣ�
(2)��������NaOH��Ӧ�����ܹ���NaOH��Һ�з���ˮ�ⷴӦ��ֲ�����Ǹ�֬�����������ˮ�����ɸ��ͣ������ܹ������ᷢ��������Ӧ����Ӧ����ʽΪ��
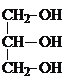 +3HNO3��
+3HNO3��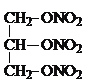 +3H2O���ʴ�Ϊ���ܣ�
+3H2O���ʴ�Ϊ���ܣ�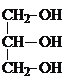 +3HNO3��
+3HNO3��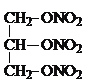 +3H2O��
+3H2O��
(3)(a)ͨ�����Ϸ���֪��A�Ľṹ��ʽ�� ��B�Ľṹ��ʽ��
��B�Ľṹ��ʽ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
��
(b)����������������������������黥Ϊͬϵ�����A���ʴ�Ϊ��A��
(c)A�Ľṹ��ʽ�� ��������2��̼̼˫���ϵ�4��Cԭ�Ӷ�����Ч������Brԭ�Ӽӳɵ�4��Cԭ���ϵIJ��ﶼ����ͬ�����A��HBr�ӳ�ʱ�IJ�����4�֣��ʴ�Ϊ��4��
��������2��̼̼˫���ϵ�4��Cԭ�Ӷ�����Ч������Brԭ�Ӽӳɵ�4��Cԭ���ϵIJ��ﶼ����ͬ�����A��HBr�ӳ�ʱ�IJ�����4�֣��ʴ�Ϊ��4��


 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
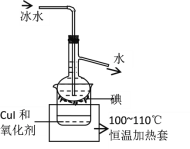
����Ŀ�����꺣�����ʵ���ʵ���ҵõ��˺����Һ����ˮ��CCl4�����ܺ�I2��I����IO3����һ�ֻ��֣���Ϊ�ⶨ��Һ�е�Ĵ�����ʽ�������շ�Һ�еĵ��CCl4�����������ʵ�鷽�������������գ�
���жϷ�Һ�е�Ĵ�����ʽ����֪��5SO32��+ 2IO3��+2H+��I2+5SO42��+H2O��
ʵ���пɹ�ѡ����Լ��ǣ�ϡ���ᡢ������Һ���Ȼ�����Һ������������Һ
��1���۲��Һ����Һ��Ϊ�������Σ��л�����____�㣨����������������������____ɫ��
��2���ӷ�Һ��ȡ����ˮ����Һ��pH��8�����μӵ�����Һ����Ϊ��ɫ���÷�ˮ�к�I2�����ӷ�Һ��ȡ����ˮ����Һ��CCl4�����ȡ����Һ��ֱ��ˮ���õ�����Һ���鲻����I2���ڣ�ȡ________ ���÷�ˮ�к���I����ȡ______���÷�ˮ������IO3����
���ո÷�Һ�еĵ��CCl4
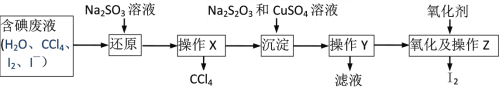
��3�����Һ�м����Թ�����Na2SO3��Һ����I2��ԭΪI�����ò�����Ŀ����_______������X������________��
��4��Na2S2O3��CuSO4��Һ��I����Ӧ����CuI������Na2S4O6��Һ����֪�ú����Һ�е�Ԫ�صĺ���Ϊ10.33g/L��������500mL�ú����Һ�еĵ⣬��������Ҫ2mol/L������ͭ��Һ_______mL��
��5����CuIת�����ձ��У���������������ͼ��ʾ��װ���з�Ӧ��һ��ʱ�����������ƿ�õ�____ɫ�Ĺ���⡣H2O2��һ��������������ɫ�������ɽ�CuI����ΪI2����ʵ�鲻ѡ��H2O2�����ܵ�ԭ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������ȷ����
A. 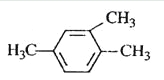 1,3,4-���ױ�
1,3,4-���ױ�
B. 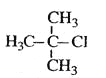 2-��-2-�ȱ���
2-��-2-�ȱ���
C. 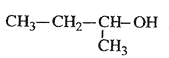 2-��-1-����
2-��-1-����
D. 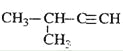 2-��-3-��Ȳ
2-��-3-��Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijͬѧ���һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ���� ������װ���� X Ϊ�����ӽ���Ĥ��

����Ҫ��ش�������⣺
(1)д�������ĵ缫��Ӧʽ_____
(2)д��ʯī�缫�ĵ缫��Ӧʽ_____________
(3)��Ӧһ��ʱ�����װ������������������Ҫ��_________(��������������ʯī����)����
(4)�����ͭ�к���п���������ʣ���װ���������ϵ缫��ӦʽΪ_________����Ӧһ��ʱ�䣬����ͭ��ҺŨ�Ƚ�_____(��������������С������������)��
(5)���ڱ�״���£��� 2.24 L �����μӷ�Ӧ������װ�������缫�����ɵ�����ķ�����ĿΪ_____����װ������������ͭ������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ӧ�ù㷺������ɫ���������������������ȶ������Ի��������������ֽ⣮��գ�
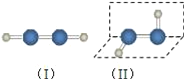
��1����������ķ��ӽṹ��ͼ�����������������__������/�Ǽ��ԣ����ӣ���ȥ����������Ϊ��������ķ��ӽṹҲ�����ǣ���ѡ�����ʵ�鷽��֤����������ķ��ӽṹΪ����__��ѡ���ţ���
a���ⶨ��������ķе�
b���ⶨ��������ֽ�ʱ�����յ�����
c���ⶨ����������H��O��O��O�ļ���
d���۲��������ϸ���Ƿ��ڵ糡��ƫת
Na2O2��K2O2�Լ�BaO2���������������ɹ������⣮ʵ���ҿ���ϡ��������������ñ���ȴ�������·�Ӧ��ȡ�������⣮
��2�������������������ʺϵ���__����Ӧ��Ϻ�__����������ƣ����ɵõ�˫��ˮ��
��3������Ӧʱû���ñ���ȴ���������������д����Ӧ�Ļ�ѧ����ʽ__�������Ը��������Һ�ζ�˫��ˮ�ķ������Բⶨ˫��ˮ��Ũ�ȣ�
��4��ȡ5.00mL ˫��ˮ��Ʒ�����Ƴ�250mL��Һ����ʵ����̱����õ���������Ҫ����Ϊ__�����������ƣ���
��5��ȡ25.00mL������Һ����0.020mol/L�����Ը��������Һ�ζ�������__������ζ��յ㣬���ĸ��������Һ15.50mL����ԭ˫��ˮ��Ʒ�к���������__ g/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��Ϊ�о�̼����ˮ��ƽ�����¶ȵĹ�ϵ������������ϵͳ�ⶨһ��Ũ��̼������Һ��pH���¶ȵĹ�ϵ���õ�������ͼ�����з������������ǣ�������
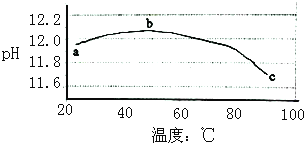
A.̼����ˮ�������ȷ�Ӧ
B.ab��˵��ˮ��ƽ�������ƶ�
C.bc��˵��ˮ��ƽ�������ƶ�
D.ˮ�ĵ���ƽ��Ҳ��pH����Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CO��H2��Co���������¶�Ϊ160��~200��ʱ�����Ժϳ����ͣ��������к�5��8��̼ԭ�ӵ���������
(1)��CnH2n+2��ʾ���ͣ�д��������Ӧ�Ļ�ѧ����ʽ____________________������ƽ��
(2)�����ܱյĺϳ�����ͨ��CO��H2��ǡ����ȫ��Ӧ����ʱ����ѹǿ������Ӧǰ��![]() ��ͨ������˵���Ƿ���������__________________��
��ͨ������˵���Ƿ���������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ� Fe(OH)2��װ������ͼ��ʾ�����е����������Ϸֱ�Ϊ����ʯī��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ������������˵����ȷ����
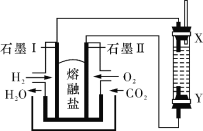
A. ʯī�缫�����ĵ缫��ӦʽΪO2+4e-=2O2-
B. X�����缫
C. ��������1mol Fe�ܽ⣬ʯī����H2 22.4 L
D. �������������ͨ���廥����X��Y��������Ҳ����, ʵ�鷽����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������۵���Ҫ��Ⱦ��ΪPM10��PM2.5��SO2��NO2��O3��CO�����ʣ����У�NO2��SO2�����γ��������Ҫ���ʣ���һ�������£������ܷ�����Ӧ��NO2��g��+SO2��g��SO3��g��+NO��g��
���������գ�
(1)��һ�������£��������ʵ�����NO2��SO2������������̶����ܱ������з�����Ӧ��������˵����Ӧ�Ѿ��ﵽƽ��״̬����______��
a��v��NO2������=v��SO2������ b�����������ԭ�Ӹ������ٸı�
c��������������ɫ���ٸı� d������������ƽ����Է����������ٸı�
(2)��������ͬʱ����NO2��SO2ʱ��SO2������ת���H2SO4����ԭ����______��
(3)��ѧ�������о����ô�������NO2��COת�������CO2��N2����Ӧ�Ļ�ѧ����ʽ��2NO2��g��+4CO��g��![]() 4CO2��g��+N2��g��+Q��Q��0���������ܱ������г���NO2��CO�����д�ʩ�����NO2ת���ʵ���______��
4CO2��g��+N2��g��+Q��Q��0���������ܱ������г���NO2��CO�����д�ʩ�����NO2ת���ʵ���______��
A��ѡ�ø�Ч���� B������NO2C�������¶� D����ѹ
(4)��д��Nԭ���������ӹ������ʽ______��д��CO2�ĵ���ʽ______��
(5)����S��N��O��C����Ԫ�ص�������ȷ����______��
A����̬�⻯���Ϊ���Է��� B������ϼ۾�����ԭ������������
C������һ��Ϊ���Ӿ��� D��ԭ�������������ֲ�ͬ��״�ĵ�����
(6)д��һ���ܹ��Ƚ�SԪ�غ�CԪ�طǽ�����ǿ���Ļ�ѧ��Ӧ����ʽ��______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com