
����Ŀ�������������۵���Ҫ��Ⱦ��ΪPM10��PM2.5��SO2��NO2��O3��CO�����ʣ����У�NO2��SO2�����γ��������Ҫ���ʣ���һ�������£������ܷ�����Ӧ��NO2��g��+SO2��g��SO3��g��+NO��g��
���������գ�
(1)��һ�������£��������ʵ�����NO2��SO2������������̶����ܱ������з�����Ӧ��������˵����Ӧ�Ѿ��ﵽƽ��״̬����______��
a��v��NO2������=v��SO2������ b�����������ԭ�Ӹ������ٸı�
c��������������ɫ���ٸı� d������������ƽ����Է����������ٸı�
(2)��������ͬʱ����NO2��SO2ʱ��SO2������ת���H2SO4����ԭ����______��
(3)��ѧ�������о����ô�������NO2��COת�������CO2��N2����Ӧ�Ļ�ѧ����ʽ��2NO2��g��+4CO��g��![]() 4CO2��g��+N2��g��+Q��Q��0���������ܱ������г���NO2��CO�����д�ʩ�����NO2ת���ʵ���______��
4CO2��g��+N2��g��+Q��Q��0���������ܱ������г���NO2��CO�����д�ʩ�����NO2ת���ʵ���______��
A��ѡ�ø�Ч���� B������NO2C�������¶� D����ѹ
(4)��д��Nԭ���������ӹ������ʽ______��д��CO2�ĵ���ʽ______��
(5)����S��N��O��C����Ԫ�ص�������ȷ����______��
A����̬�⻯���Ϊ���Է��� B������ϼ۾�����ԭ������������
C������һ��Ϊ���Ӿ��� D��ԭ�������������ֲ�ͬ��״�ĵ�����
(6)д��һ���ܹ��Ƚ�SԪ�غ�CԪ�طǽ�����ǿ���Ļ�ѧ��Ӧ����ʽ��______��
���𰸡�a c NO2���������� CD ![]()
![]() D 2NaHCO3+H2SO4�TNa2SO4+2H2O+2CO2��
D 2NaHCO3+H2SO4�TNa2SO4+2H2O+2CO2��
��������
(1)a��v��NO2������=v��SO2������=v��SO2�����������淴Ӧ������ȣ�
b���ӷ�Ӧ��ʼ���������ԭ�Ӹ���һֱ���ٸı䣻
c��������������ɫ���ٸı䣬˵������������Ũ�Ȳ��䣻
d������������ƽ����Է�������һֱ���ٸı䣻
(2)����������SO2ת���H2SO4����Ӧ������NO2��ɲ��䣻
(3)A��ѡ�ø�Ч������ƽ�ⲻ�ƶ���
B������NO2��ƽ�������ƶ���������ת���ʽ��ͣ�
C�������¶ȣ�ƽ�������ƶ���
D����ѹ��ƽ�������ƶ���
(4)����Nԭ�����������Ų�����д���������ʽ������8�����ȶ��ṹ����д��CO2�ĵ���ʽ��
(5)A������Ϊ�Ǽ��Է��ӣ�
B���������ۣ�
C�����ʯΪԭ�Ӿ��壻
D��ԭ����������s��p���ֲ�ͬ��״�ĵ����ƣ�
(6)������ǿ������ԭ��������������Ӧˮ���������Խǿ��Ԫ�طǽ�����Խǿ����������ǿ��̼�ᣬ�Դ���д��Ӧ����ʽ��
(1)a��v��NO2������=v��SO2������=v��SO2�����������淴Ӧ������ȣ���ƽ��״̬��a�������⣻
b���ӷ�Ӧ��ʼ���������ԭ�Ӹ���һֱ���ٸı䣬b�������⣻
c��������������ɫ���ٸı䣬˵������������Ũ�Ȳ��䣬��Ӧ��ƽ��״̬��c�������⣻
d������������ƽ����Է�������һֱ���ٸı䣬��d�������⣻
��ѡac����Ϊ��ac��
(2)����������SO2ת���H2SO4��������ã��ʴ�Ϊ��NO2���������ã�
(3)A��ѡ�ø�Ч������ƽ�ⲻ�ƶ�������������ת���ʲ��䣬��A �������⣻
B������NO2��ƽ�������ƶ���������ת���ʽ��ͣ���B�������⣻
C�������¶ȣ�ƽ�������ƶ�����������ת�������ߣ���C�������⣻
D����ѹ��ƽ�������ƶ�����������ת�������ߣ���D�������⣻
��ѡCD����Ϊ��CD��
(4)Nԭ���������ӹ������ʽΪ![]() ��CO2�ĵ���ʽΪ��
��CO2�ĵ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
(5)A������Ϊ�Ǽ��Է��ӣ���A��ѡ��
B���������ۣ���B��ѡ��
C�����ʯΪԭ�Ӿ��壬��C��ѡ��
D��ԭ����������s��p���ֲ�ͬ��״�ĵ����ƣ���Dѡ��
��ѡD����Ϊ��D��
(6)����ǿ����������������Ӧˮ���������Խǿ��Ԫ�طǽ�����Խǿ����������ǿ��̼�ᣬ��Ӧ����ʽ2NaHCO3+H2SO4�TNa2SO4+2H2O+2CO2������Ϊ��2NaHCO3+H2SO4�TNa2SO4+2H2O+2CO2����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊ�����л��
�ټױ� ��1��3������ϩ ��ֱ������ ��ֲ����
��գ�
��1������ʹ��ˮ������ѧ�仯��ɫ��Ҳ��ʹ���Ը��������ɫ������____�����ţ���
��2���ܺ�����������Һ��Ӧ����______�����ţ���д���÷�Ӧ����֮һ�����������Ļ�ѧ����ʽ______��
��3����֪������ϩ����ͨ��1��3������ϩ����ϩ���������ӳɷ�Ӧ�õ���
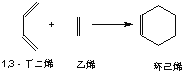
ʵ��֤�������з�Ӧ�У���Ӧ����ӵĻ���˫���Ȼ���˫�������ױ�������
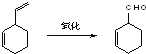
�ֽ���1��3������ϩΪ�л�ԭ�ϣ����Լ���ѡ��������;���ϳɼ������飺
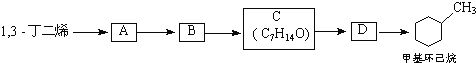
��a��д���ṹ��ʽ��A______��B_____
��b������������������黥Ϊͬϵ�����_______
��c��1mol A��1mol HBr�ӳɿ��Եõ�_____�ֲ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.һ�ܷ���ϵ�з������з�Ӧ��N2��3H2![]() 2NH3 ��H<0����ͼ��ijһʱ����з�Ӧ�����뷴Ӧ���̵����߹�ϵͼ��
2NH3 ��H<0����ͼ��ijһʱ����з�Ӧ�����뷴Ӧ���̵����߹�ϵͼ��
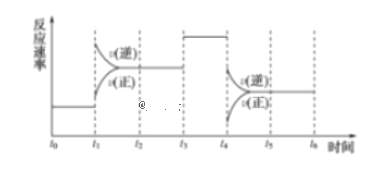
�ش��������⣺
��1������ƽ��״̬��ʱ�����___________��___________��___________��
��2��t1��t3��t4ʱ����ϵ�зֱ���ʲô���������˱仯��____________��___________��___________��
��3�����и�ʱ���ʱ�����İٷֺ�����ߵ���___________������ţ���
A��t0��t1 B��t2��t3 C��t3��t4 D��t5��t6
II.830Kʱ�����ܱ������з������п��淴Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g����H��0���Իش��������⣺
CO2��g��+H2��g����H��0���Իش��������⣺
��4������ʼʱc��CO��=2mol��L-1��c��H2O��=3mol��L-1���ﵽƽ��ʱCO��ת����Ϊ60%�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K=____________��
��5������ͬ�¶��£�����ʼʱc��CO��=1mol��L-1��c��H2O��=2mol��L-1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5mol��L-1�����ʱ�÷�Ӧ�Ƿ�ﵽƽ��״̬______������������������������ʱv������____v���棩��������������С������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ����ͪ��һ����Ҫ���л�����ԭ�ϡ�ʵ���Һϳɻ���ͪ�ķ�Ӧ���£�
����ͪ��һ����Ҫ���л�����ԭ�ϡ�ʵ���Һϳɻ���ͪ�ķ�Ӧ���£�

�������ͻ���ͪ�IJ����������ʼ��±���
���� | ��Է������� | �е�(��) | �ܶ�(g��cm��3��20��) | �ܽ��� |
������ | 100 | 161.1 | 0.9624 | ������ˮ���� |
����ͪ | 98 | 155.6 | 0.9478 | ����ˮ���������� |
����20 mL������������Na2Cr2O7������Ļ��Һ��ַ�Ӧ���Ƶ���Ҫ������ͪ��ˮ�Ĵֲ�Ʒ��Ȼ����з����ᴿ�������ᴿ�������漰����Ҫ����(δ����)��
a.����ȥ���Ѻ��ռ�151��156����֣�
b.ˮ��������(���ѷе�34.6 ������ȼ��)��ȡ����ȡҺ�����л��㣻
c.���ˣ�
d.��Һ���м���NaCl���������ͣ����ã���Һ��
e.������ˮMgSO4���壬��ȥ�л���������ˮ��
�ش��������⣺
(1)���������ᴿ�������ȷ˳����__________ (����ĸ)��
(2)b��ˮ����������ȡ��Ŀ����_______��
(3)���¹�����ȡ��Һ�����������У�����ȷ����__________��
A.ˮ��Һ�м������ѣ�ת������Һ©���У����ϲ���������ͼ������
B.���κ����Һ©���ϿڵIJ���������
C.���������������ֳַ�Һ©�����ô�Һ��ֲ�
D.��Һʱ�����Ƚ��Ͽڲ������������ϵİ��۶�©�����ϵ�С�ף��ٴ��������²�Һ��ȫ������ʱ���ٴ��Ͽڵ����ϲ�Һ��
(4)����������d�У�����NaCl�����������__________����������ѵIJ����в��õļ��ȷ�ʽΪ________��
(5)�������ʱ��һ��ʱ�����δͨ����ˮ��Ӧ��ȡ����ȷ������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ�ı�����ȷ����
A.�������NaCl��2Cl����2H2O![]() 2OH����Cl2����H2��
2OH����Cl2����H2��
B.NaHS��Һ�Լ��ԣ�HS-��H2O![]() H3O+��S2��
H3O+��S2��
C.������ˮ��Al3����3H2O��Al(OH)3�����壩��3H��
D.�Ʊ�TiO2���ۣ�TiCl4��(x��2)H2O(����) = TiO2��xH2O����4HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���� 1.0 L w mol��L��1 CH3COOH ��Һ�� 0.1 mol NaOH�����ϣ���ַ�Ӧ��Ȼ������Һ�м���CH3COOH��CH3COONa����(����������¶ȱ仯)����ҺpH�ı仯��ͼ������������ȷ����
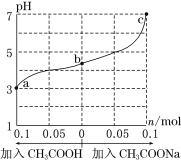
A.b����Һ��c(Na��)>c(CH3COO��)
B.����CH3COOH������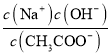 ����
����
C.c����ڣ�c(CH3COOH)+c(CH3COO��) =0.1+w
D.a��b��c��Ӧ�Ļ��Һ�У�ˮ�ĵ���̶��ɴ�С��˳����c>a>b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ�ⳣ����Ka��Kb����ˮ�����ӻ�������Kw�����ε�ˮ�ⳣ����Kh���ǵ������Һ�е���������ѧϰ������Ҫע�����ǵ���������ϵ��ͨ��ѧϰ�����֪ʶ�����������ϰ��
(1)��֪��a.�����£������NH3H2O�ĵ��볣����ͬ��
b.CH3COOH+NaHCO3�TCH3COONa+CO2��+H2O
��CH3COONH4��Һ��_______��(��"��"��"��"��"��"����ͬ)��
��NH4HCO3��Һ��________�ԣ���Һ�����ʵ���Ũ������������______���ѧʽ����
(2)����ʱ����������ζ���ˮ�����ζ�������pH=9ʱ������Һ������4c(NH4+)=7c(NH3��H2O)����ˮ�ĵ���ƽ�ⳣ��Kb(NH3��H2O)=____________������ֵ����
(3)100��ʱ��Kw=1.0��10-12�����¶��²��0.1mol/L Na2A��Һ��pH=6��
��H2A��ˮ��Һ�еĵ��뷽��ʽΪ__________________________________
�ڸ��¶��£���0.01mol/L H2A ��Һϡ��20������Һ��pH=__________
(4)��֪������CN����ˮ�ⳣ��Kh��1.61��10��5�������£��������ʵ���Ũ�ȵ�HCN��NaCN�Ļ����Һ��______(������������������������)�ԣ�c(CN��)_____(������������������������)c(HCN)��
ѧ���⣺�����ϵĽ��˼��������ƽ�ⳣ����Ka����ˮ�����ӻ�������Kw�����ε�ˮ�ⳣ����Kh��֮����ʲô��ϵ����д�����ǵĹ�ϵʽ____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ����ᶡ���Ļ����¶ȣ���Ӧ�¶ȣ���115��125�棬�����й��������±��������¹���ʵ�����Ʊ����ᶡ��������������ǣ�������
���� | ���� | 1-���� | ���ᶡ�� | 98%Ũ���� |
�е� | 117.9�� | 117.2�� | 126.3�� | 338.0�� |
�ܽ��� | ��Һˮ���л��� | ��Һˮ���л��� | ����ˮ����Һ�л��� | ��ˮ��� |
A.��Լ�����������1�����������ʵ���֮��Ӧ����1��1
B.����ˮԡ��������Ϊ���ᶡ���ķе����100��
C.�ӷ�Ӧ������������Ʒ�ķ�������Na2CO3��Һϴ�Ӻ��Һ
D.�ɴ�Ʒ�ƾ�Ʒ��Ҫ���е�һ������������ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϱ���ϩ�Ǻϳ���֬�����ӽ�����֬���ϳ��ȵ���Ҫ���壬��ͼ�DZ���ϩ�Ľṹ��ʽ��![]() ,���й��ڸ��л����˵������ȷ����(����)
,���й��ڸ��л����˵������ȷ����(����)
A. ����ϩ�ķ���ʽΪC8H8
B. ����ϩͨ���Ӿ۷�Ӧ���Ʊ��߷��ӻ�����
C. ����ϩ��������Ȼ�̼��Һ��Ӧ��![]()
D. ����ϩ�ܷ����ӳɷ�Ӧ�������ܷ���ȡ����Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com